Des AFFF aux F3 : Impact — Partie 4
Comme nous l’avons lu précédemment dans les trois premières parties de cette série d’articles, nous avons vu que les produits chimiques perfluorés ont une longue histoire s’étendant sur plus de 50 ans et qu’il est beaucoup plus complexe que de simplement considérer le PFOS, le PFHxS et le PFOA. Au contraire, il y a littéralement des milliers de produits chimiques perfluorés utilisés dans l’industrie et le commerce et se concentrer uniquement sur quelques structures nommées est inutile et une forme de « vision tunnel ».

À l’heure actuelle, des arguments solides ont été avancés pour traiter les PFAS comme une classe de composés chimiques, plutôt que comme des composés individuels nécessitant chacun l’évaluation du risque [Kwiatkowski et al (2020)], afin de contrer les inconvénients de se concentrer sur quelques PFAS particuliers. En cherchant à réglementer l’utilisation des PFAS, le concept ‘’d’applications essentielles » a été proposé par le groupe Cousins [Roy et al. (2022); Figuiére et al. (2023)].
Les intérêts universitaires et réglementaires indépendants pour cette catégorie de composés étaient pratiquement inexistants, à quelques exceptions près, jusqu’à ce que la société 3M annonce en mai 2000 qu’elle éliminait progressivement toute chimie à base de PFOS pour la remplacer par de la chimie à base de PFBS. (acide perfluorobutane sulfonique, l’homologue en C4 du PFOS). Il y eu cependant une exception notable concernant la contamination dans l’environnement, dans les travaux publiés par Jennifer Field et ses collègues de l’Oregon State University à peu près au même moment ou peu après que 3M ait annoncé son retrait de la chimie du PFOS et des émulseurs [Moody et al. (2000); Schultz et al. (2004)].
Les activités d’enquête concernant cette catégorie de composés ont commencé peu après l’annonce de 3M en mai 2000. Au début, la plupart des contributions provenaient de l’industrie elle-même ou de groupes financés par l’industrie. C’est à la fin des années 2000 que la communauté scientifique indépendante s’est rendu compte qu’il fallait faire beaucoup plus d’études sur l’impact des PFAS sur la santé humaine et l’environnement, ainsi que le nombre de publications évaluées par les scientifiques a augmenté de façon exponentielle.
Les publications concernant les PFAS dans la période précédant mai 2000 étaient seulement de l’ordre de 5 à 10 par an. Après mai 2000, ils sont passés à environ 50 par an et ont augmenté de façon exponentielle jusqu’à atteindre maintenant ~1000/an, fréquemment associés à une augmentation parallèle des articles sur les microplastiques [Bakhshoodeh et Santos (2022)], dont la figure 2(b) est tirée.
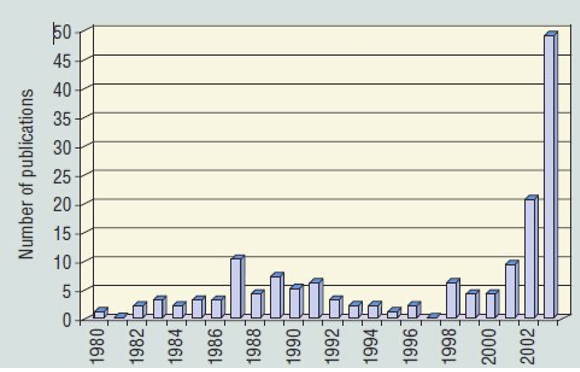
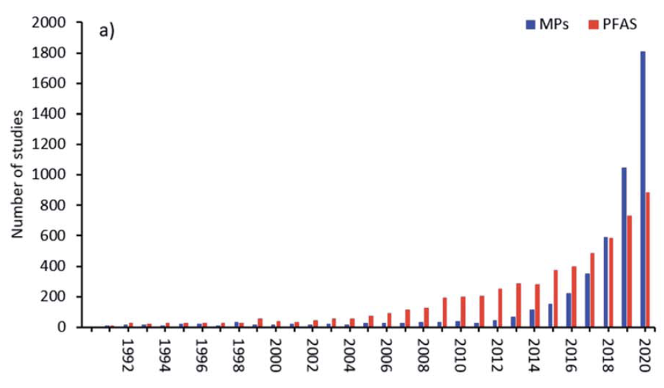
Les études publiées sur l’impact du PFOS et du PFOA dans l’environnement étaient rares avant 2001, jusqu’à ce que Giesy et Kannan [Giesy et Kannan (2001) et les articles subséquents] signalent la présence mondiale du PFOS dans la faune avec Hansen et al. trouvant du PFOS et du PFOA en aval d’une usine de fabrication située dans la rivière Tennessee [Hansen et al. (2002)], ainsi que dans des matrices biologiques en utilisant la spectrométrie de masse [(Hansen et al. (2001)].
La contamination d’échantillons de sang humain par des composés organofluorés – non présents dans le sang entreposé avant le début de la fabrication de produits chimiques fluorés- a été signalée quelques années plus tôt dans les années 1960 [Taves, D.R. (1966, 1968)] avec Guy et al. (1976). La déclaration de la présence de produits chimiques fluorés dans le plasma humain à l’aide de la spectroscopie RMN, a identifié provisoirement le PFOA comme la substance perfluorée (utilisée dans Scotchgard®) comme contaminant sanguin [Guy, W.S. et al. (1976)]. Bien qu’il y ait eu une confusion initiale quant à savoir si cette substance perfluorée était bel et bien du PFOA ou du PFOS, en raison de l’obfuscation et du refus de 3M d’identifier le PFOS, ce n’est que 25 ans plus tard que Hansen et al. (2001) ont signalé que des échantillons de plasma humain contenaient du PFOS. (moyenne de 28,4 ng/ml), PFHxS (moyenne de 6,6 ng/ml) et PFOA (moyenne de 6,4 ng/ml), confirmant les résultats de Guy et Taves.
Une poursuite intentée en 2010 par le procureur général du Minnesota contre la société 3M a révélé que la société savait que ces produits chimiques étaient accumulés dans le sang humain depuis plus de 40 ans et étaient toxiques [Lerner (2018); Swanson (2019)].
Jusqu’en 2004 environ, la littérature scientifique était dominée par des articles d’auteurs travaillant directement pour 3M ou financés par l’industrie. Après 2004, il y a eu une explosion exponentielle du travail publié indépendant concernant le
PFOS, le PFOA et d’autres PFAS, dans la mesure où ces composés organofluorés ont été étiquetés comme des « contaminants émergents ». Les PFAS sont devenus des contaminants préoccupants depuis au moins une décennie. La situation actuelle est que, même si nous en savons maintenant beaucoup sur l’environnement – distribution, devenir et toxicité pour le biote des PFAS-, c’est la technologie de traitement et d’élimination de ces matières hautement persistantes qui devrait être considérée comme une « science émergente ».
Comme indiqué précédemment, nous ne parlons pas seulement de quelques substances, mais d’au moins 6000 composés perfluorés différents qui ont été classés pour au moins un paramètre environnemental, sanitaire et/ou physicochimique dans la base de données de l’ECHA. Lors de la réunion du Comité d’examen des polluants organiques persistants de la Convention de Stockholm des Nations Unies à Rome (POPRC-14), une liste indicative des substances liées au PFOA contenait 4700 produits.
Les paramètres de santé humaine sont considérés comme d’une importance majeure pour l’exposition à long terme : cancérogénicité (C) mutagénicité (Mo); toxicité pour la reproduction (R); effets sur la lactation (L) et toxicité pour certains organes (STOT). 388 PFAS ont au moins un de ces cinq critères, dont 44 sont enregistrés par REACH dans la classification harmonisée CLP.
En ce qui concerne les dangers environnementaux, 1129 PFAS ont été enregistrés par auto-classification; la plupart d’entre eux comptant à la fois (M) mobile et / ou très persistant (vP).
En vertu de la législation communautaire sur les produits chimiques (REACH et ECHA), les risques posés par les PFAS sont classés selon le système PBT indiquant la persistance (P ou vP), la bio-accumulation (B ou vB) et la toxicité (T). Des propositions récentes de l’Agence fédérale allemande pour l’environnement (UBA) soulignent également l’importance de la mobilité (M ou vM), en particulier pour les PFAS, compte tenu de leurs propriétés vP et vM [Arp et al. (2023)]. Les substances chimiques peuvent également être identifiées comme substances très préoccupantes (SVHC) dans le cadre de REACH EC1907/2006 si elles ont des effets graves et souvent irréversibles sur la santé humaine ou l’environnement. Un exemple récent est l’acide perfluorononanoïque ou PFNA, un PFAS en C9 qui est de plus en plus couramment trouvé comme contaminant. En Europe, les composants individuels de la classification du PBT ont suscité beaucoup plus de préoccupations, tandis qu’aux États-Unis, la persistance à elle seule avec la toxicité qui l’accompagne est considérée comme moins problématique.
Persistance
Les PFAS ou leurs produits de dégradation perfluorés comptent parmi les composés organiques les plus stables sur le plan chimique et physique. Leurs chaînes de carbone perfluorées résistent à la dégradation environnementale et métabolique due aux liaisons C-F très stables. Par exemple, le tétrafluorométhane CF4 , un perfluorocarbone simple, a une demi-vie atmosphérique estimée d’environ 50000 ans avec un potentiel de réchauffement planétaire (GW) élevé [Mühle et al., 2010].
Les composés perfluorés disponibles dans le commerce sont conçus pour se dégrader rapidement une fois rejetés dans l’environnement et produisant des PFCA, des PFECA et des PFSA. Malheureusement, cela a mené dans le passé à des affirmations totalement fausses et trompeuses faites par l’industrie, en particulier aux États-Unis, selon lesquelles ces matériaux sont « biodégradables » en raison de la dégradation du groupe fonctionnel non fluoré et la règle de l’OCDE selon laquelle une substance est « facilement biodégradable » si la dégradation atteint 60 % (OCDE 301B, D et F) ou 70 % (OECD301A et E) dans les 28 jours. Cela ne signifie pas que le PFAS, utilisé par exemple dans la lutte contre l’incendie AFFF, est complètement biodégradable car la méthode COD utilisant du dichromate acide pour la mesure de l’oxydation pour donner le niveau de 100% ne tient pas compte totalement de toute matière perfluorée présente. Malheureusement, les utilisateurs finaux ont souvent supposé ou été amenés à croire par les vendeurs, et perpétrés comme un mythe par certains fabricants [Swanson, 2019], que « facilement biodégradable » signifie dégradation totale. Comme nous l’avons déjà souligné, il est toutefois logique de regrouper tous les PFAS comme étant non dégradables en fonction de leurs produits finaux de dégradation stables.
La dégradation des précurseurs entraîne souvent la formation d’intermédiaires de PFAS et de produits de dégradation ultimes avec une mobilité accrue dans l’eau et/ou l’air par des processus de dégradation chimique et biochimique oxydative dans l’environnement.
`
La durée de vie des PFAS dans l’environnement dépasse largement les critères pour les substances très persistantes (vP) de l’annexe XIII de REACH. Si les PFAS se dégradent, ils le font si lentement qu’il n’est pas observable dans les tests standard. La persistance extrême des PFAS et leur utilisation continue entraînent une exposition soutenue et des concentrations croissantes dans tous les compartiments de l’environnement. Les PFAS resteront dans l’environnement pendant très longtemps, même si les rejets sont réduits au minimum. Une contamination croissante ou héritée de l’environnement augmentera la probabilité que des effets connus et inconnus se produisent sur une échelle de temps générationnelle. Cela devrait suffire à invoquer l’application du principe de précaution [Rio 1992; Preston, 2017] à toute autre utilisation dispersive des PFAS.
Les scientifiques ont souligné dans la Déclaration d’Helsingør sur les PFAS [Scheringer et al., 2014] ainsi que dans la déclaration de Madrid [Blum et al., 2015] que la persistance très élevée en soi pose un problème et ont nommé cette approche « P-suffisante » pour les mesures réglementaires. La persistance à elle seule a justifié la réglementation des PFAS en tant que classe en Californie [Balan et al., 2021].
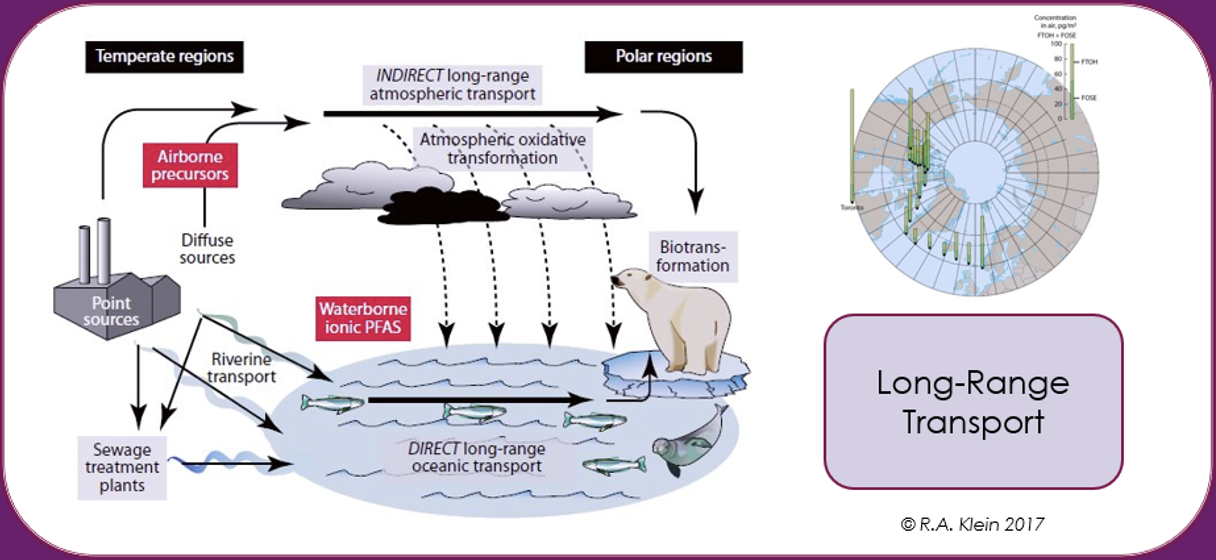
Potentiel de transport à longue distance (LRTP)
Les PFAS peuvent être transportées par l’air, l’eau et les matrices auxquelles elles sont adsorbées ou absorbées, comme la poussière, les sédiments, les aérosols marins, les courants océaniques, les animaux atmosphériques et migrateurs, ou par des matrices dans lesquelles elles sont incluses comme additifs, comme les microplastiques. En raison de leur résistance remarquable à la dégradation, cela conduit à une dispersion globale des PFAS sur de longues distances à partir du point de libération. Il a été estimé, par exemple, que pour les PFAS volatiles tels que les alcools fluorotélomères dans la haute atmosphère, les temps de circulation globale peuvent être courts de 7 à 10 jours. La propagation historique des PFAS par le biais de la LRTP par le dépôt et la contamination dans l’Arctique est bien documentée [Wilson et al. (AMAP) Secretariat, 2017].
La population inuite de l’Arctique a été signalée comme étant parmi les humains les plus contaminés de la planète, car les concentrations de SPFA dans le sang sont beaucoup plus élevées que la valeur moyenne de la population générale. Étant à ce jour éloignée de toute source industrielle de PFAS, cette contamination a été attribuée principalement à leur alimentation, basée sur le poisson, l’ours blanc et la viande de phoque, avec un impact sur la réponse immunitaire [Sonne et al., 2023].
Ainsi, la contamination de l’environnement et du biote par les PFAS ne se limite pas géographiquement à la source de la pollution, mais se généralise à l’échelle mondiale en raison de l’utilisation dispersive, comme dans les mousses anti-incendie, les mauvaises techniques d’élimination des déchets ou la production industrielle, Elle est aggravée par le transport à grande distance dans l’atmosphère et les océans.
Mobilité
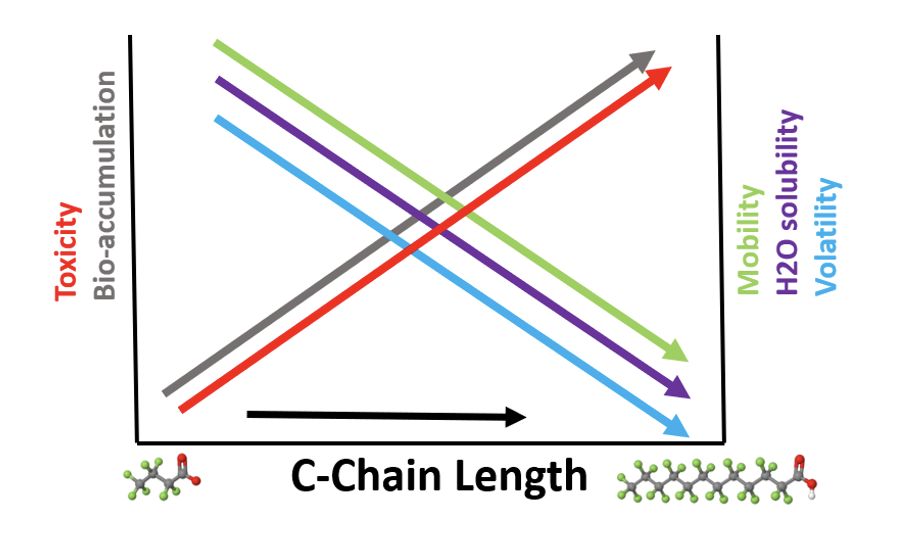
On considère généralement que les substances ayant une solubilité modérée à élevée dans l’eau et un faible potentiel d’adsorption ont une mobilité élevée dans l’environnement aqueux. Diverses études ont montré que les PFAS ont un comportement différent en fonction de la longueur de la chaîne de carbone et de la fonctionnalité.
Comme le montre la figure ci-dessous, les PFAS de longueur de chaîne plus courte sont associées à une mobilité environnementale, à une solubilité dans l’eau et à une volatilité plus élevées, ainsi qu’à un potentiel de toxicité et de bioaccumulation plus faible que les SPFA de longueur de chaîne plus longue. La combinaison d’une persistance extrême et d’une grande mobilité dans le milieu aqueux et les sols, en particulier pour les PFAS à chaîne courte comme le PFOS et ses produits apparentés, entraîne la contamination des aquifères et des rivières de l’eau potable ainsi que l’absorption dans la chaîne alimentaire – poissons, plantes et bétail.
Accumulation dans les plantes
Un article de synthèse récent sur les voies d’exposition, la bioaccumulation et les effets toxiques des PFAS sur les plantes montre que les processus de bioaccumulation des PFAS chez les plantes varient grandement en raison de la complexité de la chimie des PFAS [Li et coll., 2022].
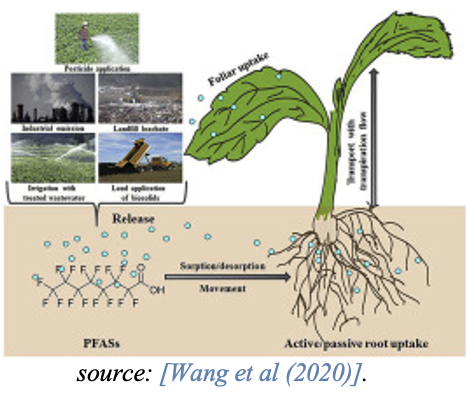
Alors que les PFAS à chaîne courte s’accumulent généralement dans les parties aériennes de la plante telles que les feuilles, les PFAS à chaîne longue s’accumulent dans les racines et présentent des facteurs de translocation plus faibles vers les parties aériennes de la plante. Ceci est influencé par la plus grande solubilité dans l’eau, la taille moléculaire inférieure et l’hydrophobicité inférieure des PFAS à chaîne courte. Des études indiquent également que les PFCA à chaîne courte sont plus efficacement absorbés par les plantes que les PFCA à chaîne longue [Felizeter et coll., 2014; Yoo et coll., 2011].
La consommation de matières végétales, p. ex., les céréales et les légumes sous forme de racines ou de parties de plantes hors sol comme les feuilles ou les tiges, constitue une source de PFAS pour les humains et les animaux.
Bio-accumulation et Bio-magnification (magnification tropique)
Dans le cadre de REACH, il a été démontré que les PFCA en C11-C14 et les PFCA en C6 satisfont au critère vB et les PFCA en C8-C10 au critère B.
Des études menées auprès d’espèces de mammifères montrent que les PFAS sont facilement absorbés et distribués dans divers tissus et que certaines PFAS (en particulier les PFAS à longue chaîne) ont une longue demi-vie dans les organismes, en particulier chez les humains où les demi-vies sont de l’ordre de plusieurs années. Des études montrent que les PFAS qui se lient à l’albumine et aux protéines de transport distribuent efficacement les PFAS dans différents tissus et améliorent le passage à travers les barrières cérébrales et placentaires, avec transfert aux nouveau-nés via le lait maternel. En raison de leurs propriétés hydrophobes et oléophobes, les PFAS ne suivent pas les schémas d’accumulation typiques, comme le partitionnement dans le tissu adipeux, mais se lient et s’accumulent plutôt dans les organes riches en protéines comme le foie.
Les PFAS s’accumulent davantage dans les êtres vivants qui respirent l’air que dans ceux qui respirent par des branchies, car, contrairement à ces derniers, les êtres pulmonés ne peuvent pas facilement éliminer les PFAS par diffusion passive. Ainsi, les méthodes établies d’essai de bioaccumulation dans les organismes aquatiques ne fonctionnent pas de façon adéquate comme méthodologie pour l’évaluation de la bioaccumulation des PFAS chez les espèces qui respirent l’air, comme l’homme.
Les acides gras perfluoroalkyles à chaîne courte sont plus facilement excrétés par l’excrétion urinaire dans les organismes respirant l’air et ont tendance à être moins bioaccumulables, tandis que le potentiel de bioaccumulation augmente habituellement avec la longueur de la chaîne perfluoroalkyle. En général, les FBC et les FBA des PFAS contenant 8 carbones ou plus augmentent de façon uniforme avec l’augmentation du nombre de carbones dans la chaîne alkyle, le potentiel de bioaccumulation le plus élevé étant observé pour les composés dont la chaîne du carbone est de 12 à 14.
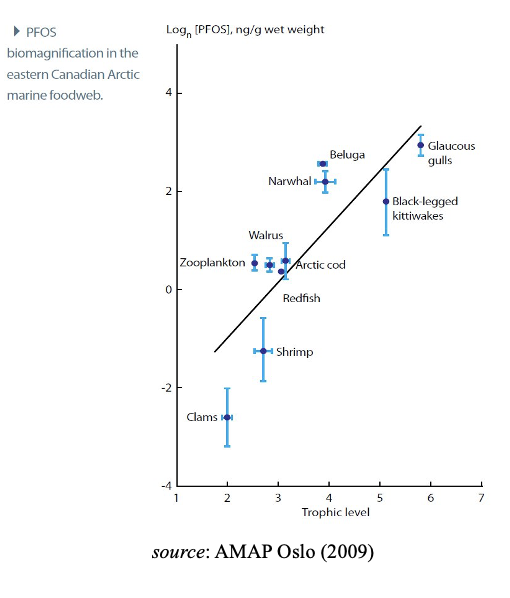
En raison de ces propriétés, de nombreux PFAS s’accumulent dans les êtres respirateurs, et les PFAS à longue chaîne se bio amplifient dans les réseaux trophiques marins et d’eau douce, atteignant des niveaux élevés chez les principaux prédateurs, y compris les humains et les espèces vulnérables. Cette augmentation de la contamination observée lors de l’ascension de la chaîne alimentaire est connue sous le nom de magnification trophique et est bien établie pour les espèces aquatiques et les prédateurs qui s’en nourrissent. Il convient de noter que, par conséquent, cela peut avoir une incidence négative sur les recommandations relatives à la consommation de viande et/ou d’entrailles de certains animaux. Les œufs de guillemot sont particulièrement riches en PFAS.
Des études sur le terrain portant sur des PFAS à chaîne longue et à chaîne courte qui peuvent être distinguées analytiquement démontrent que les PFAS (principalement les PFBA, les PFBS, les PFHpA, les PFHxA, les PFHxS, les PFOS, les 6:2 FTOH, les F-53B, les 6:2 Cl-PFESA, les TFA et les PFCAs en C9-C11) se trouvent globalement dans l’environnement des mammifères. oiseaux, poissons et autres vertébrés. En conclusion, et compte tenu de l’augmentation des éléments de preuve provenant des études de modélisation, de laboratoire et de surveillance, il y a un niveau de préoccupation croissant justifiable pour un sous-ensemble de PFAS étant bio-accumulables. La plupart des composés présentent encore de grandes incertitudes en raison du manque de données.
Effets sur la santé humaine
Un grand nombre de publications ont été publiées sur les effets du PFAS sur la santé, en particulier pour le PFOA et le PFOS. Chez les humains, de nombreux acides perfluoroalkyles (PFAA) sont facilement absorbés par inhalation ou ingestion par voie orale, alors qu’on en sait moins sur l’absorption après une exposition cutanée. Beaucoup de PFAA se lient aux protéines et sont ainsi distribués aux tissus riches en protéines comprenant le foie, les reins, et le sang. Les demi-vies estimées d’élimination humaine pour les PFAS varient de quelques jours (PFCA) et de quelques mois (PFHxA, PFBS) à quelques années (2-8) (PFOA, PFNA, PFDA, PFHxS, PFOS) ou de plus de 10 ans pour les PFCA. Les demi-vies sont beaucoup plus courtes chez les rongeurs que chez les humains et des différences de demi-vie entre les sexes sont souvent observées. Par conséquent, la toxicité observée chez les rongeurs sous-estime la toxicité pour les humains. Les PFAA sont principalement excrétés par l’urine et les fèces et sont donc libérés dans l’environnement. Les PFAA ont un fort potentiel de bioaccumulation chez l’homme, comme le montrent les longues demi-vies et la liaison aux protéines.
L’Agence européenne des normes alimentaires (EFSA) a examiné en profondeur les preuves épidémiologiques d’association entre l’exposition aux PFAS et les effets nocifs chez l’homme [EFSA, 2018; EFSA, 2020]. L’EFSA a conclu que l’augmentation des taux sériques de divers PFCA et PFSA a provoqué une réduction de la réponse immunitaire à la vaccination [Grandjean, 2012], une propension accrue aux infections, une augmentation du cholestérol sérique, une augmentation de l’alanine transférase sérique (ALT) et une réduction du poids à la naissance. L’association avec les effets immunitaires a été considérée comme le paramètre le plus sensible chez l’homme (étayé par des données provenant d’animaux de laboratoire) et l’EFSA a établi une dose hebdomadaire tolérable (DHT) de 4,4 ng/kg de poids corporel/semaine pour la somme des PFOS, PFOA, PFNA et PFHxS. [EFSA, 2020].
Des études menées sur des animaux de laboratoire dans différents groupes de PFAS démontrent que le foie, les reins, la thyroïde, le système immunitaire et la reproduction sont des cibles importantes de la toxicité des PFAS. Dans les études sur le rat, les effets les plus constants comprenaient une hypertrophie du foie, une hypertrophie hépatocellulaire, une augmentation de l’ALT sérique, une augmentation du poids des reins, une reprotoxicité, des effets sur le système lymphatique et une diminution des taux d’hormones thyroïdiennes sériques. En particulier, des effets sur le foie ont été observés pour la plupart des PFAA pour lesquels des études animales sont disponibles. Pour le PFOS, le PFOA, le PFNA et le PFDA et leurs sels, cela a donné lieu à des classifications harmonisées – CLP- pour la cancérogénicité (Carc. 2), la toxicité pour la reproduction (Repr. 1B), les effets sur la lactation (Lact.) et la toxicité pour des organes cibles spécifiques – exposition répétée (STOT RE 1, sauf pour le PFOA).
Effets cumulatifs des PFAS concomitantes
De nombreux PFAS différents coexistent dans l’environnement, l’eau potable, la nourriture et le sang humain. Ils présentent très souvent des effets similaires, principalement sur le foie, les reins, la thyroïde, les lipides sériques et le système immunitaire. Par conséquent, une évaluation des dangers et des risques tenant compte de cette exposition combinée refléterait les conditions d’exposition de façon plus réaliste que les évaluations d’un seul composé.
En raison de l’immense nombre de PFAS et du manque de données toxicologiques pour la grande majorité d’entre elles, une évaluation combinée de toutes les PFAS est impossible. Il est souligné à ce stade que l’exposition combinée à différents PFAS affectant les mêmes organes cibles peut entraîner une combinaison plus importante que les effets additifs, c.-à-d., synergisme, rendant le dépassement des seuils ou des valeurs limites plus probable que pour l’évaluation des substances individuelles.
CONCLUSION
Les PFAS sont très persistants (vP) et beaucoup sont également très bioaccumulables (vB). Les processus de transport à longue distance (LRTP) entraînent une contamination planétaire, y compris dans les régions éloignées comme l’Arctique.
Cousins et al. ont récemment introduit le concept d’avoir déjà dépassé la « limite planétaire », ce qui indique que les concentrations environnementales mondiales de PFAS dépassent déjà les niveaux acceptables durables [Cousins et al., 2022]. Cela devrait être considéré comme un avertissement contre l’utilisation continue et le rejet de PFAS dans l’environnement, en particulier à partir d’applications dispersives telles que la mousse anti-incendie AFFF.
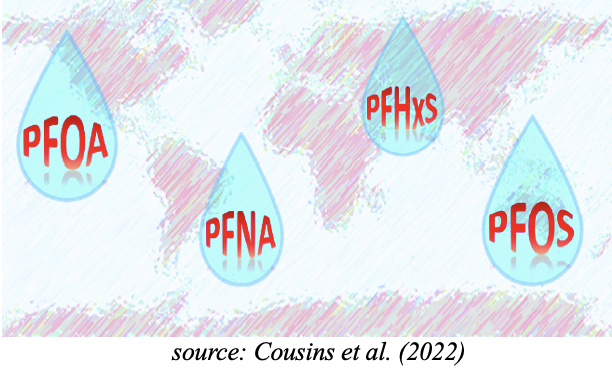
La présence permanente de PFAS dans le sang humain indique le niveau d’exposition continue de la population générale. Les PFAS sont présents dans l’eau potable et dans les stocks alimentaires. Des centaines d’études scientifiques ont mis en évidence la toxicité à long terme des PFAS, affectant le foie, les reins, la thyroïde et le système immunitaire. La présence omniprésente de PFAS dans le sang humain et de nombreuses espèces dans le monde met en évidence les dangers associés à la fabrication et à l’utilisation continues dans les produits industriels et de consommation de polluants organiques extrêmement persistants d’origine totalement anthropique, non naturels.
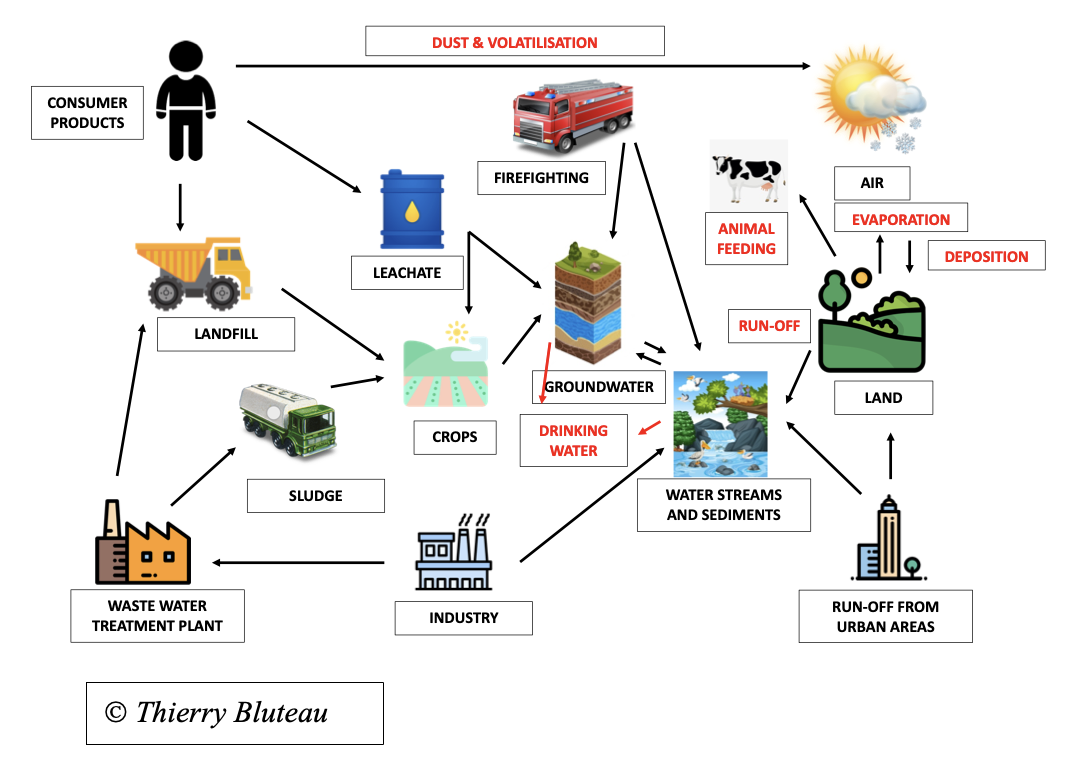
Ce schéma résume toutes les possibilités pour les PFAS de contaminer l’environnement et les êtres vivants, y compris les humains.
Références bibliographiques
Arp, H.P.M., Hale, S.E., Borchers, U., Valkov, V., Wiegand, L., Zahn, D., Neuwald, I., Nödler, K., and Scheurer, M. (2023) A prioritization framework for PMT/vPvM Substances under REACH for registrants, regulators, researchers and the water sector. German Environment Agency (Umweltbundesamt) Report 22/2023 pp. 1-238.
Bakhshoodeh, R., and Santos, R.M. (2022) Comparative bibliometric trends of microplastics and perfluoroalkyl and polyfluoroalkyl substances: how these hot environmental remediation research topics developed over time. RSC Advances 12, 4973-4987.
Bălan, .A., ChanderMathrani, V., Fengmao Guo, D., and Algazi1, A.M. (2021) Regulating PFAS as a Chemical Class under the California Safer Consumer Products Program. Environ. Health Perspect, 129 (20) February 025001, 1-9.
Blum, A., Balan, S.A., Scheringer, M., Trier, X., Goldenman, G., Cousins, I.T., Diamond, M., Fletcher, T., Higgins, C.P., Lindeman, A.E., Peaslee, G., de Voogt, P., Wang, Z., and Weber, R. (2015) The Madrid Statement on Poly- and Perfluoroalkyl Substances (PFASs). Environ. Health Perspect. 123 (5) May A107-A11.
Cousins, I.T., Johansson, J.H., Salter, M.E., Sha, B. and Scheringer, M. (2022) Outside the Safe Operating Space of a New Planetary Boundary for Per- and Polyfluoroalkyl Substances (PFAS). Environ. Sci. Technol. 2022, 56, 11172−11179.
European Food Standards Agency (EFSA) (2018) Risk to human health related to the presence of perfluorooctane sulfonic acid and perfluorooctanoic acid in food. EFSA Journal 16(12), 5194.
European Food Standards Agency (EFSA) (2020) Risk to human health related to the presence of perfluoroalkyl substances in food. EFSA Journal 18(9), 6223.
Felizeter, S., McLachlan, M.S., and de Voogt, P. (2014) Root uptake and translocation of perfluorinated alkyl acids by three hydroponically grown crops. J. Agric. Food Chem. 62 (15), 3334-42.
Figuiére, R., Borchert, F., Cousins, I.T., and Ågerstrand, M. (2023) The essential-use concept: a valuable tool to guide decision-making on applications for authorization under REACH? Environmental Sciences Europe 35 (5) 1-12.
Giesy, J.P., and Kannan, K. (2001) Global Distribution of Perfluorooctane Sulfonate in Wildlife. Environ. Sci. Technol. 35(7) 1339-1342.
Grandjean, P., Andersen, E.W., Budtz-Jørgensen, E., Nielsen, F., Mølbak, K., Weihe, P., and Heilmann, C. (2012) Serum vaccine antibody concentrations in children exposed to perfluorinated compounds. JAMA 307(4), 391-7.
Guy, W.S., Taves, D.R., Brey, W.S. (1976) Fluorocompounds in Human Plasma: Prevalence and Characterization. Biochemistry Involving Carbon-Fluorine Bonds, ACS Symposium. 117-134
Hansen, K.J., Clemen, L.A., Eellefson, M.E., and Johnson, H.O. (2001) Compound-specific quantitative characterization of organic fluorochemicals in biological matrices. Environ. Sci. Technol. 35(4) 766-770.
Hansen K.J., Johnson, H.O., Eldridge, J.S., Butenhoff, J.L., and Dick, L.A. (2002) Quantitative Characterization of Trace Levels of PFOS and PFOA in the Tennessee River. Environ. Sci. Technol. 36(8) 1681-1685.
Kwiatkowski, C.F., Andrews, D.Q., Birnbaum, L.S., Bruton, T.A., DeWitt, J.C., Knappe, D.R.U., Maffini, M.V., Miller, M.F., Pelch, K.E., Reade,A., Soehl, A., Trier, X., Venier, M., Wagner, C.C., Wang, Z., and Blum, A. (2020) Scientific Basis for Managing PFAS as a Chemical Class. Environ. Sci. Technol., 7, 532−543.
Lerner, S. (2018)] 3M knew about the Dangers of PFOS and PFOA Decades Ago, Internal Documents Show. The Intercept July 18 2018.
Li, J., Sun, J., and Li, P. (2022) Exposure routes, bioaccumulation and toxic effects of per- and polyfluoroalkyl substances (PFASs) on plants: A critical review,. Environ. International 158, 106891.
Moody, C.A., and Field, J.A. (2000) Perfluorinated Surfactants and the Environmental Implications of Their Use in Fire-Fighting Foams. Environ, Sci. Technol. 34(18), 3864-3869.
Mühle, J., Ganesan, A.L. , Miller, B.R, Salameh, P.K., Harth, C.M., Greally, B.R.,, Rigby, M., Porter, L.W., Steele, L.P., Trudinger, C.M.,, Krummel, P.B., O’Doherty, S.,, Fraser, P.J., Simmonds, P.G., Prinn, R.G.,, and Weiss, R.F.. (2010) Perfluorocarbons in the global atmosphere: tetra-fluoromethane, hexafluoroethane, and octafluoropropane. Atmos. Chem. Phys. 10, 5145–5164.
Preston, B.A. (2017) The Judicial Development of the Precautionary Principle. Queenslnad Government Environmental Management of Firefighting Foam Policy Implementation Seminar, Brisbane 21 Febraury 2017. pp. pp.1`-26. < https://lec.nsw.gov.au >.
Rio Convention (1992) UN Conference on Environment and Development, Rio de Janiero, Brazil, 3-14 June 1992.
Roy, M.A., Cousins, I.T., Harriman, H., Scheringer, M., Tickner. J.A., and Wang, Z. (2022) Combined Application of the Essential-Use and Functional Substitution Concepts: Accelerating Safer Alternatives Environ. Sci. Technol. 56, 9842−9846.
Scheringer, M., Trier, X., Cousins, I.T., de Voogt, P., Fletcher, T., Wang, Z., and Webster, T.F. (2014) Helsingør Statement on poly- and perfluorinated alkyl substances (PFASs). Chemosphere 114 (2014) 337–339.
Schultz, M.M., Barofsky, D.F., and Field, J.A. (2004) Quantitative Determination of Fluorotelomer Sulfonates in Groundwater by LC MS/MS. Environ. Sci. Technol. 38 (6) 1828-1835.
Sonne, C., Desforges, J.-P., Bossi, R., and Long, M. (2023) Assessment of Exposure to Perfluorinated Industrial Substances and Risk of Immune Suppression in Greenland and its Global Context: a Mixed-Methods Study. Lancet Planetary Health 7 (7), E570-E579, July 2023.
Swanson, L. (2019) Testimony of Lori Swanson Former Minnesota Attorney General before the Committee on Oversight and Reform Subcommittee on Environment United States House of Representatives. September 10, 2019. pp. 1-66.
Taves, D.R. (1966) Normal human serum fluoride concentrations. Nature 211, 192-193.
Taves, D.R. (1968) Evidence that there are Two Forms of Fluoride in Human Serum. Nature 217, 1050-1051.
Wang, W., Rhodes, G., YU, X., and Li, H. (2020) Uptake and accumulation of per- and polyfluoroalkyl substances in plants. Chemosphere 261, 127584.
Wilson, S., Fuglestad, J., Larsen, J.-R., Pawlak, J., and Utne, I. (2017) (AMAP Secretariat). Chemicals of Emerging Arctic Concern. Arctic Monitoring and Assessment Programme (AMAP), Oslo, Norway. xvi+353pp.
Yoo, H., Washington, J.W., Jenkins, T.M., and Ellington, J.J. (2011) Quantitative determination of perfluorochemicals and fluorotelomer alcohols in plants from biosolid-amended fields using LC/MS/MS and GC/MS. Environ. Sci. Technol. 45(19), 7985-90.
