De los AFFF a los F3 : Impacto — Parte 4
Como se detalló anteriormente en las tres primeras partes de esta serie de artículos, hemos visto que los perfluoroquímicos tienen una larga historia que abarca más de 50 años, y son mucho más complejos que sólo considerar los PFOS, PFHxS y PFOA. Por el contrario, hay literalmente miles de productos perfluoroquímicos utilizados en la industria y el comercio y centrarse únicamente en unas pocas estructuras mencionadas sería inútil y una forma de ‘visión de túnel’.

Actualmente se han presentado argumentos sólidos para tratar los PFAS como una clase de compuestos químicos, y no como compuestos individuales, que requieren la evaluación del riesgo [Kwiatkowski et al (2020)], como un medio para contrarrestar las desventajas de concentración en unos pocos denominados PFAS. Al tratar de regularse el uso de los PFAS, el concepto de ‘usos esenciales’ ha sido propuesto por el grupo Cousins [Roy et al. (2022); Figuiére et al. (2023)].
El interés académico y reglamentario independiente en esta clase de compuestos era prácticamente inexistente, con algunas excepciones notables, hasta que la Compañía 3M anunció en mayo del 2000 que estaba eliminando gradualmente toda la química basada en los PFOS, sustituyéndola por la química PFBS (ácido perfluorobutano sulfónico, el homólogo C4 del PFOS). Una excepción notable que fue muy relevante para entender la contaminación ambiental causada por las espumas AFFF, fue el trabajo publicado por Jennifer Field y sus colegas en la Universidad Estatal de Oregón, alrededor del mismo tiempo o poco después de que 3M anunciara su retiro de la química del PFOS y fabricación de espuma [Moody et al. (2000); Schultz et al. (2004)].
La actividad de investigación relativa a esta clase de compuestos comenzó poco después del anuncio de 3M en mayo del 2000. Al principio, la mayoría de las contribuciones provenían de la propia industria o de grupos financiados por la industria. Fue entonces a finales de la década del 2000 cuando la comunidad científica independiente se dio cuenta que había mucho más que se necesitaba investigar sobre el impacto de los PFAS, tanto para la salud humana como para el medio ambiente, dando como resultado que el número de publicaciones revisadas por pares aumentaran exponencialmente.
Las publicaciones relacionadas con los PFAS en el período previo a mayo del 2000, sólo se situaban entre 5 y 10 por año. Después de mayo del 2000 éstos aumentaron alrededor de 50 por año, y han aumentado exponencialmente desde ahora alcanzando ~1000/año, frecuentemente asociado con un aumento paralelo en artículos sobre microplásticos [Bakhshoodeh y Santos (2022)], de quién se toma la Figura 2(b).
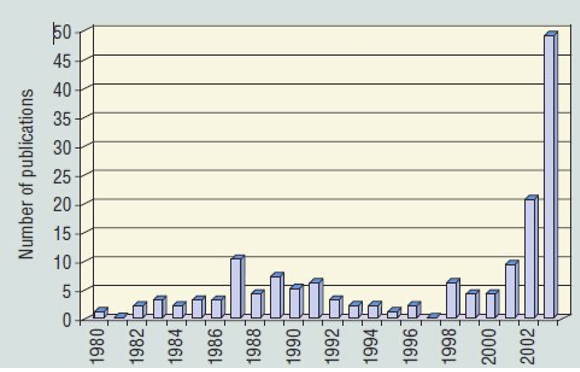
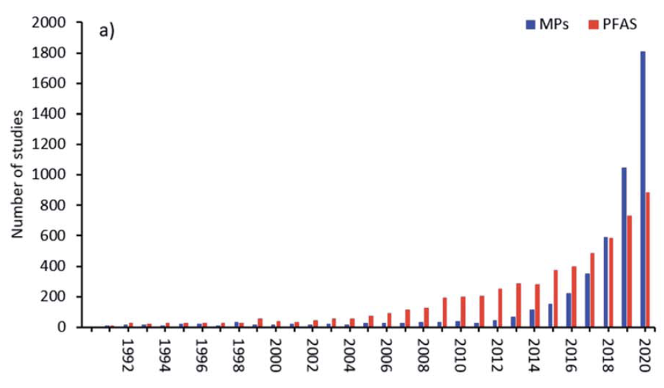
Los estudios publicados sobre la escala del medio ambiente por los PFOS y los PFOA eran escasos antes del 2001, hasta que Giesy y Kannan [Giesy y Kannan (2001) y artículos posteriores] informaron acerca de la presencia mundial de los PFOS en la vida silvestre, con Hansen et al. encontrando PFOS y PFOA en las aguas debajo de una planta de fabricación en el río Tennessee [Hansen et al. (2002)], así como en matrices biológicas utilizando espectrometría de masas [(Hansen et al. (2001)].
Aunque la contaminación de muestras de sangre humana con sustancias organofluorinas no presentes en la sangre almacenada y tomada antes de que comenzara la fabricación fluoroquímica, se había informado algunos años antes desde la década de 1960 [Taves, D.R. (1966, 1968)] con Guy et al. (1976) de reportar la presencia de fluoroquímicos en el plasma humano usando espectroscopia RMN, identificando tentativamente PFOA, como el fluoroquímico, usado en Scotchgard como contaminante de la sangre [Guy, W.S. et al. (1976)]. Aunque hubo confusión inicial sobre si este fluoroquímico era efectivamente PFOA o PFOS, como resultado de la ofuscación y la negativa de identificar el PFOS por parte de 3M, no fue hasta 25 años después que Hansen et al. (2001) informó que las muestras de plasma humano contenían PFOS (promedio 28,4 ng/ml), PFHxS (promedio 6,6 ng/ml) y PFOA (promedio 6,4 ng/ml), confirmando así los hallazgos de Guy y Taves.
Una demanda presentada en el 2010 por el Fiscal General del Estado de Minnesota contra la Compañía 3M, reveló que la compañía sabía que estos productos químicos se acumularon en la sangre humana durante más de 40 años y eran tóxicos [Lerner (2018); Swanson (2019)].
Hasta aproximadamente el 2004 la literatura científica estuvo dominada por artículos de autores que trabajaban directamente para 3M o financiados por la industria. Después del 2004 a habido una explosión exponencial de trabajos publicados independientes, relacionados con los PFOS, PFOA y otros PFAS, en la medida en que éstos compuestos organofluorinos han sido etiquetados como ‘contaminantes emergentes’. Los PFAS han surgido como contaminantes de preocupación durante al menos una década. La situación actual es que, aunque ahora conocemos una cantidad considerable de distribución, destino y toxicidad para la biota de los PFAS, es la tecnología para la remediación y eliminación de estos materiales altamente persistentes que debe considerarse como ‘ciencia emergente’.
Cómo se ha dicho antes, no sólo estamos hablando de unas pocas sustancias, sino de toda una familia de al menos 6.000 compuestos perfluorocompuestos diferentes, que han sido clasificados para al menos un objetivo medioambiental, de salud humana y/o físico en la base de datos ECHA. En la reunión del Comité de Examen de los Contaminantes Orgánicos Persistentes del Convenio de Estocolmo de las Naciones Unidas en Roma (CECOP-14), una lista indicativa de sustancias relacionadas con el PFOA contenía 4.700 entradas.
Los criterios de valoración de la salud humana se consideran de gran importancia para la exposición a largo plazo: carcinogenicidad ©; mutagenicidad (M0; toxicidad reproductiva (R); efectos de la lactancia (L) y toxicidad de órganos específicos (STOT). 388 PFAS tienen al menos uno de estos cinco parámetros, de los cuales 44 están registrados en la clasificación armonizada.
En cuanto a los riesgos ambientales, se han registrado 1129 PFAS por autoclasificación; la mayoría de ellos contando como móviles (M) y/o muy persistentes (vP).
En virtud de la legislación de la UE sobre sustancias y preparados químicos (REACH y ECHA), los riesgos que plantean los PFAS se clasifican utilizando el sistema PBT que indica persistencia (P o vP), bioacumulación (B o vB) y toxicidad (T). Las recientes propuestas de la Agencia Federal Alemana de Medio Ambiente (UBA), también destacan la importancia de la movilidad (M o vM), especialmente para los PFAS en vista de sus propiedades vP y vM [Arp et al. (2023)]. Los productos químicos también pueden ser identificados como sustancias muy preocupantes (SVHC), en virtud de REACH EC1907/2006 , si tienen efectos graves y a menudo irreversibles sobre la salud humana o el medio ambiente. Un ejemplo reciente es el ácido perfluorononanoico o PFNA, un PFAS, que cada vez se encuentra más comúnmente como contaminante. En Europa ha habido mucha más preocupación con los componentes individuales de la clasificación PBT, mientras que en los Estados Unidos la persistencia por sí sola con la toxicidad que la acompaña se considera menos un problema.
Persistencia
Los PFAS o sus productos de degradación perfluorados, se encuentran entre los compuestos orgánicos más estables química y físicamente conocidos. Sus cadenas de carbono perfluoradas resisten la degradación ambiental y metabólica debido a los enlaces C-F muy estables. Por ejemplo, el tetrafluorometano, el CF4 y el perfluorocarbono simple, tienen una vida media atmosférica estimada de ~50.000 años con un alto potencial de calentamiento global (GW) [Mühle et al.(2010)].
Los compuestos de perfluoro disponibles en el mercado están diseñados para degradarse rápidamente una vez liberados en el medio ambiente, produciendo PFCA, PFECA y PFSA. Lamentablemente, esto ha llevado en el pasado a afirmaciones totalmente falsas y engañosas hechas por la industria, especialmente en los Estados Unidos, afirmando que estos materiales son «biodegradables´´ basados en la degradación de losgrupo funcional fluorado y la norma de la OCDE, que una sustancia es ‘fácilmente biodegradable’ si la degradación alcanza 60% (OCDE 301B, D y F) o 70% (OECD301A y E) dentro de 28 días. Esto no significa que los PFAS, por ejemplo, en la AFFF de lucha contra incendios sea completamente biodegradable, ya que el método de DQO que utiliza dicromato ácido para la medición de la oxidación para obtener el nivel del 100% no tiene en cuenta en absoluto cualquier material perfluorado presente. Lamentablemente, los usuarios finales a menudo han asumido o han sido llevados a creer por los vendedores, y perpetrados como un mito por cierto fabricante [Swanson, 2019], que ‘fácilmente biodegradable’ significa degradación total. Sin embargo, como se señaló anteriormente, tiene sentido agrupar todos los PFAS como No degradables según sus productos finales de degradación estables.
La descomposición de los precursores a menudo conduce a la formación de productos intermedios y de degradación final de los PFAS con una mayor movilidad en el agua y/o el aire a través de procesos de degradación química oxidativa y bioquímica en el medio ambiente.
La vida útil de los PFAS en el medio ambiente supera ampliamente los criterios para sustancias muy persistentes (vP) del anexo XIII del REACH. Si los PFAS se degradan, lo hacen tan lentamente que no es observable en las pruebas estándar. La extrema persistencia de los PFAS y su uso continuado conduce a una exposición sostenida y a concentraciones crecientes en todos los compartimentos del entorno. Los PFAS permanecerán en el entorno durante mucho tiempo, incluso si las liberaciones se minimizan. El aumento o el legado de contaminación del medio ambiente aumentará la probabilidad de que se produzcan efectos conocidos y desconocidos en una escala de tiempo generacional. Esto debería invocar la aplicación del principio de precaución [Río 1992; Preston, 2017] a cualquier otro uso dispersivo de PFAS
Los científicos señalaron en la Declaración de Helsingør sobre los PFAS [Scheringer et al., 2014] así como en la declaración de Madrid [Blum et al., 2015] que la persistencia muy alta por sí sola presenta un problema y han llamado a esto el «enfoque P-suficiente» para la acción reguladora. La persistencia por sí sola justificó la regulación de los PFAS cómo clase en California [Balan et al., 2021].
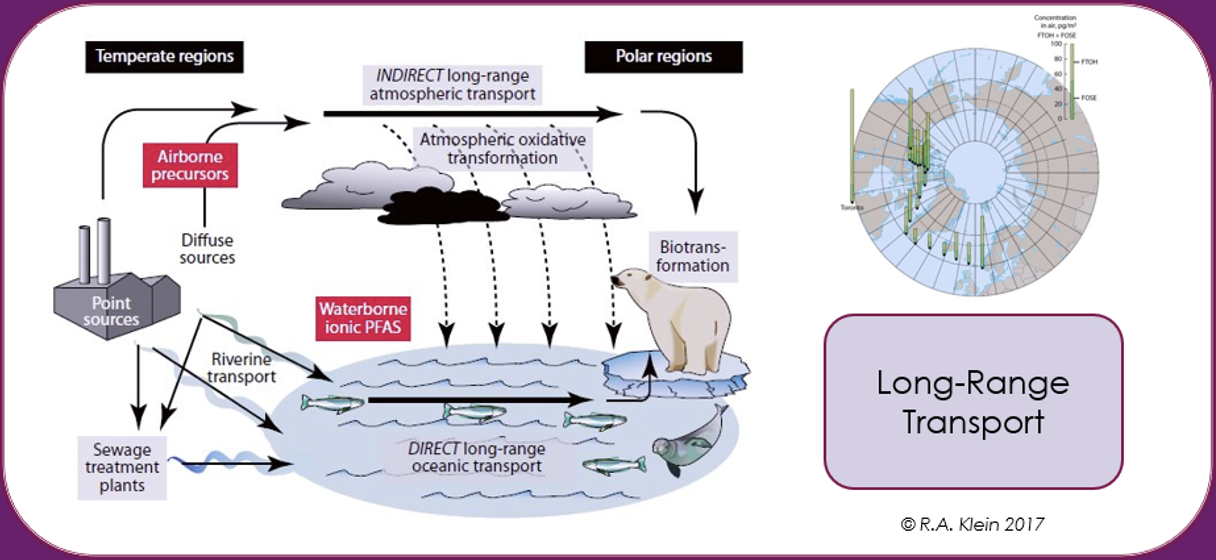
Potencial de transporte a larga distancia (LRTP)
Los PFAS pueden transportarse por aire, agua y matrices a las que se adsorben o absorben como polvo, sedimentos, aerosoles marinos, corrientes oceánicas, animales atmosféricos migratorios, o mediante matrices en las que se incluyen como aditivos, como microplásticos. Debido a su notable resistencia a la degradación, esto conduce a la dispersión global de los PFAS a largas distancias, desde el punto de liberación. Se ha estimado, por ejemplo, que para los PFAS volátiles como los alcoholes fluorotelómeros en la atmósfera superior, los tiempos de circulación global pueden ser cortos de 7 a 10 días. La propagación histórica a través de LRTP de PFAS a través de deposiciones y contaminación en el Ártico está bien documentada [Wilson et al. (AMAP) Secretariat, 2017].
Se ha informado de que la población inuit en el Ártico son uno de los seres humanos más contaminados del planeta, ya que las concentraciones de los PFAS en su sangre son mucho más altas que el valor promedio para la población en general. Al estar tan alejada de cualquier fuente industrial de los PFAS, esta contaminación se ha atribuido principalmente a su dieta, que se basa en pescado, oso polar y carne de foca, con un impacto en la respuesta inmune [Sonne et al., 2023].
Por lo tanto, la contaminación del medio ambiente y la biota por los PFAS no se limita geográficamente solo a la fuente de la contaminación, sino que se generaliza a escala mundial debido a su uso dispersivo, como en espumas contra incendios, malas técnicas de eliminación de los residuos o producción industrial, el transporte a larga distancia en la atmósfera y los océanos.
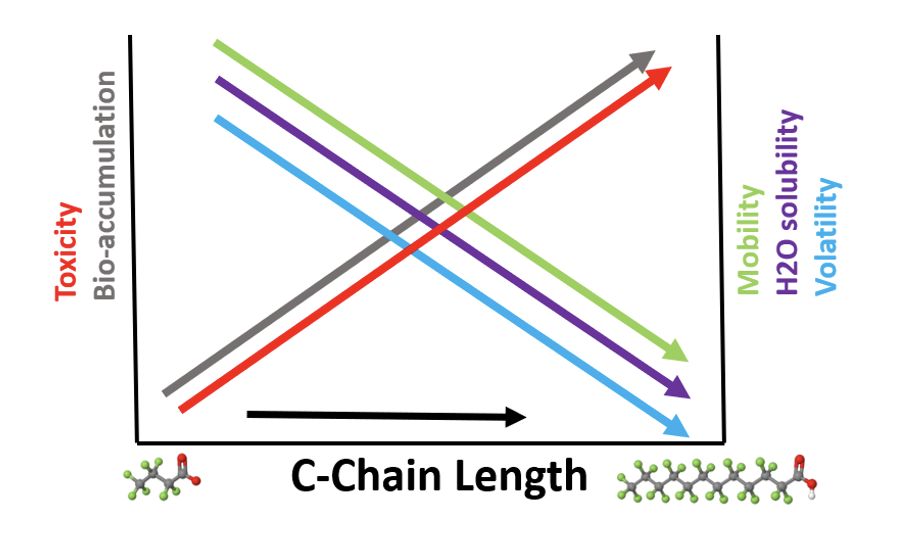
Movilidad
Generalmente se considera que las sustancias con solubilidad moderada a alta en agua, asociada con bajo potencial de absorción, tienen una alta movilidad en el ambiente acuoso. Varios estudios han demostrado que los PFAS tienen un comportamiento diferente dependiendo fuertemente de la longitud de la cadena de carbono y de la funcionalidad.
Como se muestra en la figura a continuación, los PFAS de cadena más corta están asociados con una mayor movilidad ambiental, solubilidad y volatilidad del agua, así como con un menor potencial de toxicidad y bioacumulación que los PFAS de cadena más larga. La combinación de extrema persistencia y alta movilidad en el compartimiento acuoso y los suelos, especialmente para los PFAS de cadena más corta como PFPeS y PFBS, conduce a la contaminación de los acuíferos de agua potable y ríos, así como la absorción en la cadena alimentaria – peces, plantas y ganado.
Acumulación en las plantas
Un reciente artículo de revisión sobre las vías de exposición, bioacumulación y efectos tóxicos de los PFAS en las plantas muestra que, los procesos de bioacumulación de los PFAS en las plantas varían mucho debido a la complejidad de la química de los PFAS [Li et al., 2022].
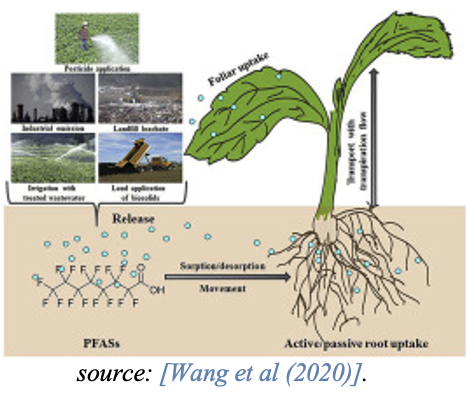
fuente: [Wang et al (2020)].
Mientras que los PFAS de cadena corta típicamente se acumulan en las partes de la planta por encima del suelo, como las hojas, los PFAS de cadena larga se acumulan en las raíces y muestran factores de translocación más bajos a las partes de la planta por encima del suelo. Esto está influenciado por la mayor solubilidad en agua, menor tamaño molecular y menor hidrofobicidad de los PFAS de cadena corta. Los estudios también indican que los PFCA de cadena corta son absorbidos más eficazmente por las plantas que los PFCA de cadena larga [Felizeter et al., 2014; Yoo et al., 2011].
El consumo de material vegetal, por ejemplo, granos y verduras, ya sea como raíces o partes de plantas por encima del suelo, como hojas o tallos, funciona como una fuente de los PFAS para seres humanos y animales.
Bioacumulación y Biomagnificación (magnificación tropical)
En el marco de REACH, se ha demostrado que los CFCA C11-C14 y C6-PFSA cumplen el criterio vB y los C8-C10-PFCA el criterio B.
Los estudios con especies de mamíferos muestran que los PFAS se absorben y distribuyen fácilmente a través de varios tejidos y que algunos PFAS (particularmente el PFAS de cadena larga) tienen vidas medias largas en organismos, especialmente en humanos, donde las vidas medias son del orden de años. Los estudios muestran que la unión de PFAS a la albúmina y las proteínas transportadoras distribuyen eficientemente los PFAS en diferentes tejidos, y mejora el paso a través de las barreras cerebrales y placentarias, con transferencia a los recién nacidos a través de la leche materna. Debido a sus propiedades hidrofóbicas y oleofóbicas, los PFAS no siguen patrones de acumulación típicos, como la partición en el tejido adiposo, sino que se unen y acumulan en órganos ricos en proteínas como el hígado.
Los PFAS se acumulan más en los organismos que respiran aire en comparación con los organismos que respiran por las branquias, porque a diferencia de estos últimos, los respiradores de aire no pueden eliminar fácilmente los PFAS por difusión pasiva. Por lo tanto, los métodos establecidos de pruebas de bioacumulación en organismos acuáticos no funcionan adecuadamente como metodología para las evaluaciones de bioacumulación de los PFAS en especies que respiran aire como el hombre, Desafortunadamente, los datos de bioacumulación de laboratorio son muy limitados para los respiradores de aire.
Los PFAS de cadena corta se expulsan más fácilmente por la vía urinaria en organismos que respiran aire y, tienden a ser menos bioacumulativos, mientras que el potencial de bioacumulación suele aumentar con la longitud de la cadena de perfluoroalquilo. En general, los BCFs y BAFs de PFAS con 8 o más carbonos aumentan uniformemente con el creciente número de carbonos en la cadena de alquilo, con el mayor potencial de bioacumulación visto para compuestos con 12 a 14 longitudes de cadena de carbono.
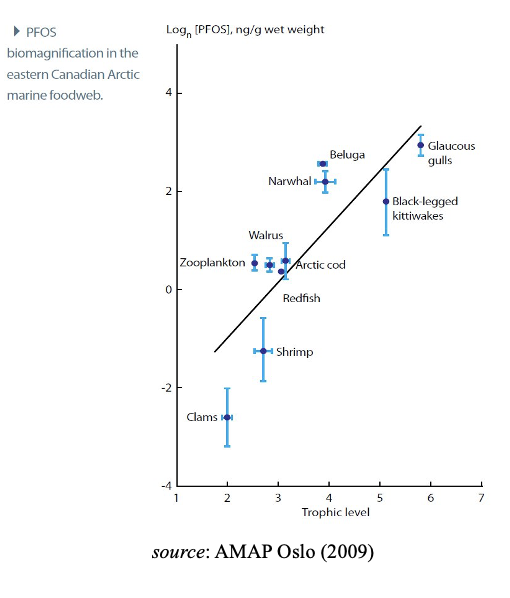
Debido a estas propiedades, muchos PFAS se acumulan en respiradores de aire, y los PFAS de cadena larga se magnifican en las redes alimentarias marinas y de agua dulce, alcanzando altos niveles en los principales depredadores, incluidos los humanos y las especies vulnerables. Este aumento en la contaminación visto como uno, asciende la cadena alimentaria y se conoce como aumento trófico y está bien establecido para las especies acuáticas y los depredadores que se alimentan de ellos. Cabe señalar que, por consiguiente, esto puede afectar negativamente a las recomendaciones relativas al consumo de carne y/o entrañas de determinados animales. Los huevos de arao depredador marino superior, son particularmente altos en PFAS.
Los estudios de campo sobre los PFAS de cadena larga y corta que pueden distinguirse analíticamente, demuestran que los PFAS (principalmente PFBA, PFBS, PFHpA, PFHxA, PFHxS, PFOS, FOSA, 6:2 FTOH, F-53B, 6:2 Cl-PFESA, TFA y C9-C11 PFCA), se encuentran globalmente en todo el entorno, aves, peces y otros vertebrados. En conclusión, y teniendo en cuenta las líneas de evidencia cada vez mayores de los estudios de modelización, laboratorio y vigilancia, existe un nivel de preocupación creciente justificable para un subconjunto de los PFAS que es bio-acumulativo, mientras que grandes incertidumbres permanecen para la mayoría de los compuestos debido a la falta de datos.
Efectos sobre la salud humana
Se ha publicado una gran cantidad de literatura sobre los efectos de los PFAS en la salud, especialmente para los PFOA y los PFOS. En los seres humanos, muchos ácidos perfluoroalquilos (PFAA), se absorben fácilmente por inhalación o ingestión oral, mientras que se sabe menos sobre la absorción después de la exposición cutánea. Muchos PFAA se unen a las proteínas y por lo tanto se distribuyen a los tejidos ricos en proteínas, incluyendo el hígado, los riñones y la sangre. Las semividas estimadas de eliminación humana para los PFAA varían desde unos pocos días (PFBA) y meses (PFHxA, PFBS) hasta unos pocos (2-8) años (PFOA, PFNA, PFDA, PFHxS, PFOS), o >10 años para PFUnDA. Las semividas son mucho más cortas en roedores que en humanos y a menudo se observan diferencias en las semividas entre sexos. En consecuencia, la toxicidad observada en roedores subestima la toxicidad para los seres humanos. Los PFAA se expulsan principalmente a través de la orina y las heces y, por lo tanto, se liberan al medio ambiente. Los PFAA tienen un marcado potencial de bioacumulación en los seres humanos, como lo demuestran las largas semividas y la unión de proteínas.
La Agencia Europea de Normas Alimentarias (EFSA), revisó exhaustivamente las pruebas epidemiológicas de la asociación entre la exposición a los PFAS y los efectos adversos en humanos [EFSA, 2018; EFSA, 2020]. La EFSA concluyó que el aumento de los niveles séricos de diversos PFCA y PFSA provocó una reducción de la respuesta inmunitaria a la vacunación [Grandjean, 2012], una mayor propensión a las infecciones, un aumento del colesterol sérico, un aumento de la alanina transferasa sérica (ALT) y una reducción del peso al nacer. Se consideró que la asociación con los efectos inmunitarios era el criterio de valoración más sensible en los seres humanos (respaldado por datos de animales de experimentación) y, sobre esta base, la EFSA estableció una ingesta semanal tolerable (TWI) de 4,4 ng/kg de peso corporal/semana para la suma de PFOA, PFOS, PFNA y PFHxS [EFSA, 2020].
Los estudios experimentales con animales en diferentes grupos de PFAS, demuestran que el hígado, el riñón, la tiroides, el sistema inmunitario y la reproducción son los órganos principales para la toxicidad de los PFAA. En estudios con ratas, los efectos más consistentes incluyeron agrandamiento del hígado, hipertrofia hepatocelular, aumento del ALT sérico, aumento del peso renal, reprotoxicidad, efectos sobre el sistema linfático y disminución de los niveles séricos de hormona tiroidea. En particular, se han observado efectos hepáticos en la mayoría de los PFAA, para los que se dispone de estudios en animales. Para el PFOS, el PFOA, el PFNA y el PFDA y sus sales, esto ha dado lugar a clasificaciones armonizadas para carcinogenicidad (Carc. 2), toxicidad reproductiva (Repr. 1B), efectos de la lactancia (Lact.) y toxicidad específica del órgano diana – exposición repetida (STOT RE 1, excepto PFDA).
Efectos acumulativos de los PFAS coexistentes
Muchos PFAS diferentes coexisten en el medio ambiente, el agua potable, los alimentos y la sangre humana. Los PFAS presentan efectos similares, tales como efectos sobre el hígado, el riñón, la tiroides, los lípidos séricos y el sistema inmunológico. En consecuencia, una evaluación de los peligros y riesgos teniendo en cuenta esa exposición combinada, reflejaría las condiciones de exposición de manera más realista que las evaluaciones de compuestos individuales.
Debido a la inmensa cantidad de PFAS y la falta de datos toxicológicos para la gran mayoría de ellos, una evaluación combinada para todos los PFAS es inalcanzable. Se subraya en este punto que la exposición combinada a diferentes PFAS que afectan a los mismos órganos diana puede dar lugar a más efectos combinados que los aditivos, es decir, sinergismo, haciendo más probable que se superen los umbrales o valores límite que para la evaluación de sustancias individuales por sí solos.
CONCLUSIÓN
Los PFAS son muy persistentes (vP) y muchos también son muy bioacumulativos (vB). Los procesos de transporte de largo alcance (LRTP, por sus siglas en inglés) producen contaminación planetaria, incluyendo regiones remotas como el Ártico.
Cousins et al. han introducido recientemente el concepto de haber superado ya el ‘límite planetario’, indicando que las concentraciones ambientales globales para los PFAS ya exceden los niveles sostenibles tolerables [Cousins et al., 2022]. Esto debe tratarse como una advertencia contra el uso continuo y la liberación de los PFAS al medio ambiente, especialmente de aplicaciones dispersas como la espuma antiincendios AFFF.
La presencia permanente de los PFAS en la sangre humana, indica el nivel de exposición continua de la población en general. Los PFAS están presentes en el agua potable y en la existencia de los alimentos. Cientos de estudios científicos han destacado la toxicidad a largo plazo de los PFAS, afectando al hígado, los riñones, la tiroides y el sistema inmunológico. La presencia omnipresente de los PFAS en la sangre humana y otras especies en todo el mundo pone de relieve los peligros asociados con la fabricación y el uso continuado de productos industriales y del consumo de contaminantes orgánicos extremadamente persistentes de origen totalmente antropogénico, no ocurriendo naturalmente.
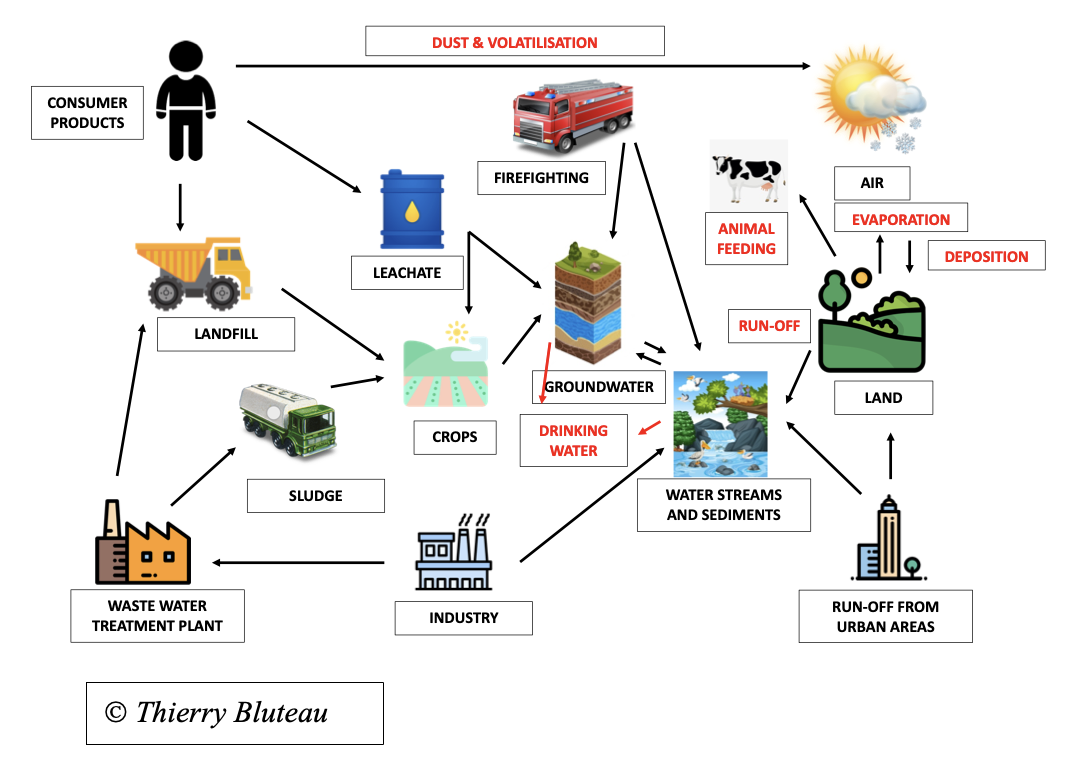
Este esquema resume todas las posibilidades de que los PFAS contaminen el medio ambiente y los seres vivos, incluidos los humanos.
Referencias
Arp, H.P.M., Hale, S.E., Borchers, U., Valkov, V., Wiegand, L., Zahn, D., Neuwald, I., Nödler, K., and Scheurer, M. (2023) A prioritization framework for PMT/vPvM Substances under REACH for registrants, regulators, researchers and the water sector. German Environment Agency (Umweltbundesamt) Report 22/2023 pp. 1-238.
Bakhshoodeh, R., and Santos, R.M. (2022) Comparative bibliometric trends of microplastics and perfluoroalkyl and polyfluoroalkyl substances: how these hot environmental remediation research topics developed over time. RSC Advances 12, 4973-4987.
Bălan, .A., ChanderMathrani, V., Fengmao Guo, D., and Algazi1, A.M. (2021) Regulating PFAS as a Chemical Class under the California Safer Consumer Products Program. Environ. Health Perspect, 129 (20) February 025001, 1-9.
Blum, A., Balan, S.A., Scheringer, M., Trier, X., Goldenman, G., Cousins, I.T., Diamond, M., Fletcher, T., Higgins, C.P., Lindeman, A.E., Peaslee, G., de Voogt, P., Wang, Z., and Weber, R. (2015) The Madrid Statement on Poly- and Perfluoroalkyl Substances (PFASs). Environ. Health Perspect. 123 (5) May A107-A11.
Cousins, I.T., Johansson, J.H., Salter, M.E., Sha, B. and Scheringer, M. (2022) Outside the Safe Operating Space of a New Planetary Boundary for Per- and Polyfluoroalkyl Substances (PFAS). Environ. Sci. Technol. 2022, 56, 11172−11179.
European Food Standards Agency (EFSA) (2018) Risk to human health related to the presence of perfluorooctane sulfonic acid and perfluorooctanoic acid in food. EFSA Journal 16(12), 5194.
European Food Standards Agency (EFSA) (2020) Risk to human health related to the presence of perfluoroalkyl substances in food. EFSA Journal 18(9), 6223.
Felizeter, S., McLachlan, M.S., and de Voogt, P. (2014) Root uptake and translocation of perfluorinated alkyl acids by three hydroponically grown crops. J. Agric. Food Chem. 62 (15), 3334-42.
Figuiére, R., Borchert, F., Cousins, I.T., and Ågerstrand, M. (2023) The essential-use concept: a valuable tool to guide decision-making on applications for authorization under REACH? Environmental Sciences Europe 35 (5) 1-12.
Giesy, J.P., and Kannan, K. (2001) Global Distribution of Perfluorooctane Sulfonate in Wildlife. Environ. Sci. Technol. 35(7) 1339-1342.
Grandjean, P., Andersen, E.W., Budtz-Jørgensen, E., Nielsen, F., Mølbak, K., Weihe, P., and Heilmann, C. (2012) Serum vaccine antibody concentrations in children exposed to perfluorinated compounds. JAMA 307(4), 391-7.
Guy, W.S., Taves, D.R., Brey, W.S. (1976) Fluorocompounds in Human Plasma: Prevalence and Characterization. Biochemistry Involving Carbon-Fluorine Bonds, ACS Symposium. 117-134
Hansen, K.J., Clemen, L.A., Eellefson, M.E., and Johnson, H.O. (2001) Compound-specific quantitative characterization of organic fluorochemicals in biological matrices. Environ. Sci. Technol. 35(4) 766-770.
Hansen K.J., Johnson, H.O., Eldridge, J.S., Butenhoff, J.L., and Dick, L.A. (2002) Quantitative Characterization of Trace Levels of PFOS and PFOA in the Tennessee River. Environ. Sci. Technol. 36(8) 1681-1685.
Kwiatkowski, C.F., Andrews, D.Q., Birnbaum, L.S., Bruton, T.A., DeWitt, J.C., Knappe, D.R.U., Maffini, M.V., Miller, M.F., Pelch, K.E., Reade,A., Soehl, A., Trier, X., Venier, M., Wagner, C.C., Wang, Z., and Blum, A. (2020) Scientific Basis for Managing PFAS as a Chemical Class. Environ. Sci. Technol., 7, 532−543.
Lerner, S. (2018)] 3M knew about the Dangers of PFOS and PFOA Decades Ago, Internal Documents Show. The Intercept July 18 2018.
Li, J., Sun, J., and Li, P. (2022) Exposure routes, bioaccumulation and toxic effects of per- and polyfluoroalkyl substances (PFASs) on plants: A critical review,. Environ. International 158, 106891.
Moody, C.A., and Field, J.A. (2000) Perfluorinated Surfactants and the Environmental Implications of Their Use in Fire-Fighting Foams. Environ, Sci. Technol. 34(18), 3864-3869.
Mühle, J., Ganesan, A.L. , Miller, B.R, Salameh, P.K., Harth, C.M., Greally, B.R.,, Rigby, M., Porter, L.W., Steele, L.P., Trudinger, C.M.,, Krummel, P.B., O’Doherty, S.,, Fraser, P.J., Simmonds, P.G., Prinn, R.G.,, and Weiss, R.F.. (2010) Perfluorocarbons in the global atmosphere: tetra-fluoromethane, hexafluoroethane, and octafluoropropane. Atmos. Chem. Phys. 10, 5145–5164.
Preston, B.A. (2017) The Judicial Development of the Precautionary Principle. Queenslnad Government Environmental Management of Firefighting Foam Policy Implementation Seminar, Brisbane 21 Febraury 2017. pp. pp.1`-26. < https://lec.nsw.gov.au >.
Rio Convention (1992) UN Conference on Environment and Development, Rio de Janiero, Brazil, 3-14 June 1992.
Roy, M.A., Cousins, I.T., Harriman, H., Scheringer, M., Tickner. J.A., and Wang, Z. (2022) Combined Application of the Essential-Use and Functional Substitution Concepts: Accelerating Safer Alternatives Environ. Sci. Technol. 56, 9842−9846.
Scheringer, M., Trier, X., Cousins, I.T., de Voogt, P., Fletcher, T., Wang, Z., and Webster, T.F. (2014) Helsingør Statement on poly- and perfluorinated alkyl substances (PFASs). Chemosphere 114 (2014) 337–339.
Schultz, M.M., Barofsky, D.F., and Field, J.A. (2004) Quantitative Determination of Fluorotelomer Sulfonates in Groundwater by LC MS/MS. Environ. Sci. Technol. 38 (6) 1828-1835.
Sonne, C., Desforges, J.-P., Bossi, R., and Long, M. (2023) Assessment of Exposure to Perfluorinated Industrial Substances and Risk of Immune Suppression in Greenland and its Global Context: a Mixed-Methods Study. Lancet Planetary Health 7 (7), E570-E579, July 2023.
Swanson, L. (2019) Testimony of Lori Swanson Former Minnesota Attorney General before the Committee on Oversight and Reform Subcommittee on Environment United States House of Representatives. September 10, 2019. pp. 1-66.
Taves, D.R. (1966) Normal human serum fluoride concentrations. Nature 211, 192-193.
Taves, D.R. (1968) Evidence that there are Two Forms of Fluoride in Human Serum. Nature 217, 1050-1051.
Wang, W., Rhodes, G., YU, X., and Li, H. (2020) Uptake and accumulation of per- and polyfluoroalkyl substances in plants. Chemosphere 261, 127584.
Wilson, S., Fuglestad, J., Larsen, J.-R., Pawlak, J., and Utne, I. (2017) (AMAP Secretariat). Chemicals of Emerging Arctic Concern. Arctic Monitoring and Assessment Programme (AMAP), Oslo, Norway. xvi+353pp.
Yoo, H., Washington, J.W., Jenkins, T.M., and Ellington, J.J. (2011) Quantitative determination of perfluorochemicals and fluorotelomer alcohols in plants from biosolid-amended fields using LC/MS/MS and GC/MS. Environ. Sci. Technol. 45(19), 7985-90.
