Del AFFF al F3 : Química – Parte 2
En esta parte nos ocuparemos de la química involucrada en la formulación de las espumas de clase A, para combustibles carbonosos, y las espumas heredadas de clase B AFFF basadas en la química del PFOS para fuegos de hidrocarburos líquidos y solventes polares.
En la parte 1 de esta serie de artículos, vimos que las espumas contra incendios AFFF contienen varias sustancias perfluoroalkil (PFAS); sin embargo, la espuma contra incendios es solo una de muchas aplicaciones
Los PFAS se han utilizado durante décadas en más de 200 otras aplicaciones industriales y domésticas, como el envasado de alimentos, el tratamiento del cuero y los textiles, la protección anticontaminación de alfombras y prendas de vestir, los detergentes, la impermeabilización y la impermeabilización del aceite, las pinturas y los barnices, tintas de impresión, cromado, ropa exterior y de protección (PPE) para los servicios de emergencia y militares. Estas sustancias perfluoradas son ampliamente utilizadas ya que ofrecen una combinación de propiedades únicas, incluyendo la capacidad de repeler el agua (hidrofobicidad), la capacidad de repeler los aceites (oleofobicidad), la capacidad de reducir la tensión superficial de soluciones acuosas a menos de 20 dyne/cm y con ella actuando como detergentes, emulsionantes, agentes humectantes y dispersantes.
La OCDE (2.021) aclaró recientemente la definición de lo que constituye un PFAS, al mismo tiempo reconoce la dan Buck et al (2011), de la siguiente manera:
«Los PFAS se definen como sustancias fluoradas que contienen al menos un complemento fluorado de átomo de carbono de metilo o metileno (sin ningún átomo de H/Cl/Br/I unido a él), p.ej. con algunas excepciones observadas, cualquier producto químico con al menos un grupo metilo perfluorado (-CF3) o un grupo metileno perfluorado (-CF2-) es un PFAS.»
Se han identificado más de 800 productos actualmente disponibles en el mercado, pero es probable que la verdadera lista de PFAS utilizados en el comercio y la industria sea de 10.000 o más. El Convenio de Estocolmo de las Naciones Unidas, ha incluido 4.700 sustancias relacionadas con el PFOA solamente. El PFAS comenzó a fabricarse en grandes cantidades a principios de los años 50, todos ellos son antropogénicos creados por humanos utilizando síntesis química, no existen de forma natural. Sus productos finales perfluorados extremadamente estables y químicamente resistentes de la avería en el medio ambiente han sido identificados durante mucho tiempo como ‘productos químicos para siempre’, por ejemplo, por científicos y periodistas como Rebecca Renner [«Creciente preocupación por los productos químicos perfluorados» (2001) Environ. Sci. Technol. 35(7) 154A-160A; «El largo y corto de reemplazos perfluorados» (2006) Environ. Sci. Technol. 40(1) 12-13] o Sharon Lerner escribiendo en el Intercept [«Químicos tóxicos descubiertos en cientos de productos» Sharon Lerner (The Intercept December 2020)].
Hay que subrayar que, aunque todavía se hace referencia de manera común e inexacta a los ‘contaminantes emergentes’, los PFAS han surgido realmente como contaminantes preocupantes durante al menos 10 años, y ya no deben describirse como ‘emergentes’. Por otra parte, la tecnología para hacer frente a los desechos de PFAS todavía está en fase de desarrollo.
Las espumas ignífugas se clasifican de clase A, adecuadas para combustibles carbonosos como madera, papel o vegetación, que actúan como agentes humectantes que mejoran la penetración del agua en los incendios profundos y no contienen tensioactivos fluorados, únicamente tensioactivos hidrocarbonados; por otro lado, las espumas de clase B están específicamente formuladas para hidrocarburos líquidos como la gasolina y los disolventes polares como el etanol. Las espumas modernas de la clase B pueden contener tensioactivos fluorados y ser capaces de la formación de película en la interfaz aire-combustible (AFFF), o completamente libres de flúor como las espumas F3, especialmente formuladas ya que contienen solo tensioactivos hidrocarbonados. Curiosamente, las espumas sin flúor de clase B (F3) se pueden usar eficazmente para los incendios de clase A y clase B, a diferencia de las AFFF.
Espumas de clase A para combustibles carbonosos
Las espumas contra incendios de clase A, se utilizan ampliamente en todo el mundo, especialmente en Australia, Estados Unidos y el sur de Europa, para incidentes que involucren combustibles carbonosos, como, por ejemplo, incendios de casas estructurales, basureros de plásticos y neumáticos, así como incendios de pastizales, bosques y matorrales. Ted Schaefer entonces trabajando para 3M Australia a finales de 1.980 desarrolló una de las primeras espumas eficaces de clase A, «3M Fire-Brake BFFF», reconocida en 2001 por la Academia Australiana de Ciencias Tecnológicas e Ingeniería como una de las 100 mejores invenciones australianas del siglo XX.
Las espumas de clase A, se comportan de forma muy diferente a los AFFF que contienen tensioactivos fluorados, ya que están específicamente formulados para penetrar eficazmente en el combustible carbónico, como la vegetación compactada, el papel o la madera, utilizando tensioactivos hidrocarbonados especializados, no ajenos a un detergente líquido. Los tensioactivos fluorados, diseñados para su aplicación en superficie de incendios de hidrocarburos líquidos o disolventes polares, no son ni de lejos tan eficientes para penetrar tan profundamente incendios sentados, y las afirmaciones de algunos en la industria de que sus productos AFFF se pueden utilizar como espumas duales de clase A / clase B son francamente engañosas.


Mister H: Penetración por Clase A Mister F: No penetración por Clase B AFFF
(Bluteau 2007)
El comportamiento diferente de una espuma de Clase A basada en tensioactivos hidrocarbonados y un AFFF fluorado de Clase B, hacia el combustible carbonoso puede visualizarse utilizando una caricatura utilizada por uno de nosotros en 2007. Mister H, una verdadera espuma de Clase A puede penetrar el combustible carbonoso debido a sus características humectantes optimizadas; Mister F, un tensioactivo fluora do basado en AFFF, no puede debido a sus propiedades hidrofóbicas y oleofóbicas.
Espumas AFFF clase B para hidrocarburos líquidos y disolventes polares
El primer informe de una espuma acuosa formadora de película (AFFF), llamada LightWater, por R.L. Tuve et al del Laboratorio de Investigación Naval y la Compañía 3M, marzo de 1.964, de la capacidad de la espuma de supresión de vapor y película que se forma en la superficie con combustibles inflamables de bajo punto de inflamación como gasolina, demostró que era 1200% más eficaz que las espumas de proteína estándar en condiciones idénticas.
Los compuestos probados en formulaciones espumosas pertenecían a la clase general de derivados del ácido perfluorosulfónico, algunos de los cuales eran sales cuaternarias, otros eran alcoholes, ésteres, sales aniónicas de ácidos carboxílicos sulfonamido sustituidos, etc. Todos ellos solubles en agua, Los fluorocarbonos de alto peso molecular mostraron una dramática depresión de la tensión superficial del agua por debajo de 20 dyne/cm. En general, son insensibles a los electrolitos y muestran actividad superficial cuando se disuelven en disolventes orgánicos.
La primera patente para una AFFF se concedió a Richard Tuve y Edwin Jablonski, en junio de 1.966 [1], lo que representa una nueva era en la lucha contra el fuego, espumas que iban a durar los próximos 30-40 años hasta que la 3M Company Minnesota se retiró de la química basada en el PFOS por completo en mayo de 2000.
La información de la literatura sobre patentes da una visión fascinante de los derivados utilizados en estos primeros AFFF. Se utilizaron derivados de sulfonamida de perfluorooctano (PFOSA) y ácido carboxílico de perfluorooctano (PFOA). Como se informó en la patente de 1.966, éstas primeras formulaciones incluyen las sales de amonio cuaternario del PFOS y los derivados del amido del PFOA:
C8F17-SO2NH2-(CH3)3N(CH3)3+I–
C7F15-CONH-(CH3)3N(CH3)3+I–
un amino betaína anfótero derivado de PFOA
C7F15-CONH-(CH2)3–N+(CH3)2-CH2-CH2-COO–
y la sal potásica de un derivado de la sulfonamida PFOS
C8F17SO2N(C2H5)-CH2COOK
La sal de potasio del PFOS en forma de tensoactivo FC-95 también se utilizó en las primeras espumas.
Curiosamente, 50 años más tarde fue que Barzen-Hanson et al en 2017 [2] del grupo de Jennifer Field en la Universidad Estatal de Oregón, identificó una amplia gama de otros derivados, o sus productos de desagregación, que involucraban 40 clases diferentes en AFFF heredados.
Fluoración electroquímica (ECF) – el proceso Simons
La Compañía 3M anunció en mayo de 2.000 que estaba eliminando gradualmente la producción de tensioactivos fluorados basados en la química PFOS, y que se retiraba por completo del mercado de espumas contra incendios fluoradas AFFF, lo que marcaba el fin de la disponibilidad de las formulaciones Light Water™ y Light Water™ ATC™ (3M Company- 2000). Otros productos que utilizan PFOS incluyen tratamientos repelentes de agua y manchas ScotchGuard™. Se cree que la producción de PFOS por parte de 3M Company cesó por completo alrededor de 2002, siendo reemplazada por el compuesto de la cadena más corta PFBS, aunque se cree que la producción de PFOS y PFHxS continuó en China y la India.
 Hasta el año 2.000, los PFOS se fabricaban mediante el proceso de fluoración electroquímica (ECF) de Simons (3M Company, 1.999; Ignat’ev et al, 2009; Sartori e Ignat’ev, 1998). Este proceso implica reemplazar los átomos de hidrógeno del sulfonato de octilo usando fluoruro de hidrógeno electrolíticamente para generar fluoruro de sulfonilo de perfluorooctano, PFOSF.
Hasta el año 2.000, los PFOS se fabricaban mediante el proceso de fluoración electroquímica (ECF) de Simons (3M Company, 1.999; Ignat’ev et al, 2009; Sartori e Ignat’ev, 1998). Este proceso implica reemplazar los átomos de hidrógeno del sulfonato de octilo usando fluoruro de hidrógeno electrolíticamente para generar fluoruro de sulfonilo de perfluorooctano, PFOSF.
C8H17SO3H + HF ==>> C8F17(C=O)F
PFOSF es fluoruro de acilo altamente reactivo y es el material de partida para la preparación de derivados del PFOS como la sulfonamida PFOSA o N-etil-PFOSA, por ejemplo:
C8F17(C=O)F + C2H5NH2 ==>> C8F17(C=O)-NH-C2H5
PFOSF es fluoruro de acilo altamente reactivo y es el material de partida para la preparación de derivados del PFOS como la sulfonamida PFOSA o N-etil-PFOSA, por ejemplo:
PFOSF es fluoruro de acilo altamente reactivo y es el material de partida para la preparación de derivados del PFOS como la sulfonamida PFOSA o N-etil-PFOSA, por ejemplo:
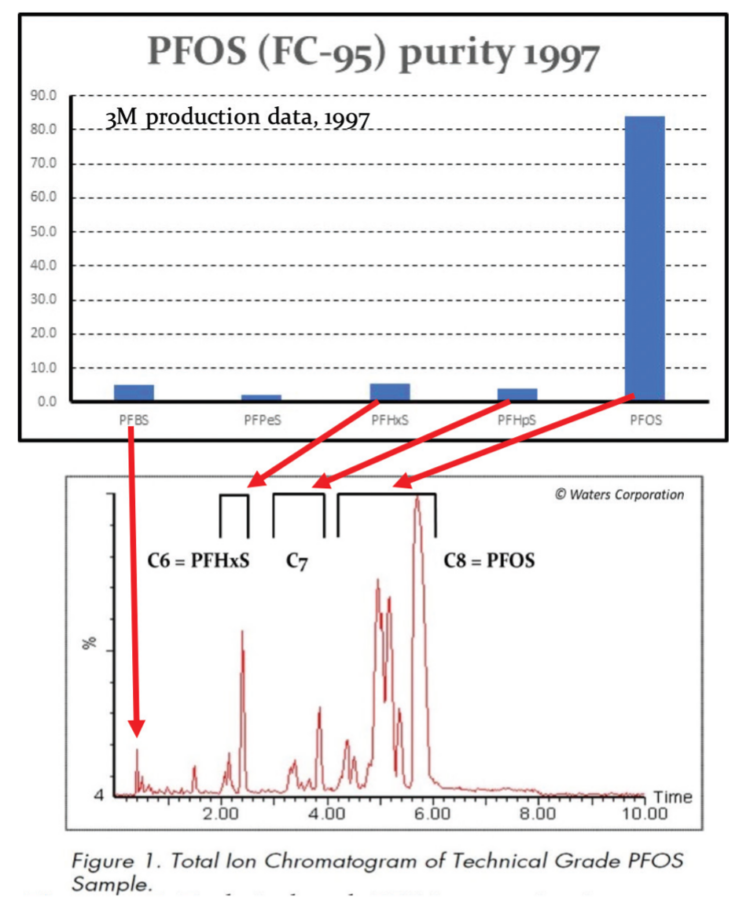
La producción de PFOSF mediante fluoración electroquímica (ECF) fue, y sigue siendo, un proceso inherentemente ‘sucio’ que dio lugar a una amplia gama de isómeros estructurales, tanto de cadena recta como ramificados con CF-CF3 y C-(CF3)2 cadenas laterales, así como homólogos de longitud de cadena pares e impares como C4 PFBS, C6 PFHxS y C7 PFHpS.
Como resultado, el PFOS de grado técnico siempre estuvo y sigue estando contaminado con un porcentaje significativo de PFHxS. Además, las cadenas de perfluoroalkil del PFOS y de la PFHxS pueden formar hélices izquierdas o derechas, lo que da lugar a pseudoracemates detectados en seres humanos (Wang et al, 2011; Naile et al , 2016; Sasaki et al, 2018). Citando la propuesta de restricción de PFHxS de la ECHA (13 de junio de 2019):
«… Las fuentes indican que cuando se fabrican compuestos perfluorados suele formarse una mezcla de compuestos de diferente longitud de cadena, con cantidades típicas de PFHxS formadas cuando se fabrican PFOS entre el 4 y el 14% ( de (BiPRO, 2018) citando (Ren, 2016)). Estas cifras están respaldadas por mediciones de PFHxS en productos comerciales de PFOS, a saber, 3,5-9,8% en el FC-95 de 3M (de (BiPRO, 2018) que cita 3M (2015) y 11,2% – 14,2% en tres productos de China (Jiang et al, 2015). BiPRO también nota, sin embargo, que la cantidad del componente C6 puede reducirse por purificación en diferentes etapas de la línea de producción….»
La importancia de los niveles relativamente altos del ácido sulfónico perfluorohexano homólogo C6, PFHxS, en estas formulaciones de AFFF es que PFHxS es más tóxico y bioacumulativo que el PFOS, tiene un medio biológico más largo de vida en los seres humanos, y también ha sido incluida en los anexos del Convenio de Estocolmo de las Naciones Unidas para su restricción. Desafortunadamente, algunos fabricantes, especialmente en Asia, han utilizado PFHxS como una ‘sustitución lamentable’ del PFOS.
El uso del proceso ECF para producir ácidos sulfónicos y carboxílicos perfluorados, como el PFOS y el PFOA y sus derivados, ha sido resumido por Buck et al [2011], como se muestra a continuación.
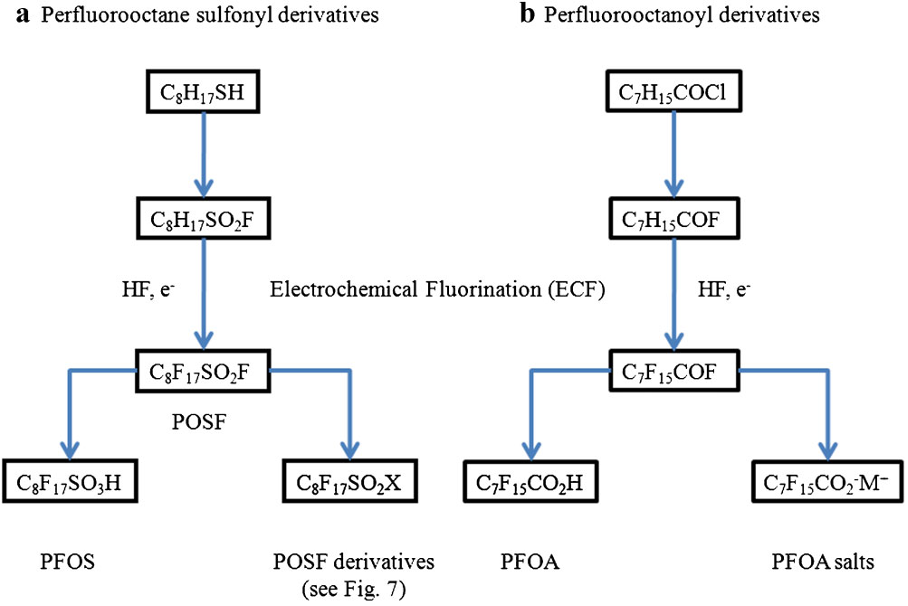
Fuente: Buck et al (2011)
Seguimos en parte 3.
Referencias
Barzen-Hanson, K.A., Roberts, S.C., Choyke, S., Oetjen, K., McAlees, A., Riddell, N., McCrindle, R., Ferguson, P.L., Higgins, C.P., and Field, J.A.. (2017) “Discovery of 40 Classes of Per- and Polyfluoroalkyl Substances in Historical Aqueous Film-Forming Foams (AFFFs) and AFFF-Impacted Groundwater” Environ, Sci. Technol. 51, 2047-2057.
Benskin J.P., De Silva A.O., Martin J.W. (2010) Isomer Profiling of Perfluorinated Substances as a Tool for Source Tracking: A Review of Early Findings and Future Applications. Rev. Environ. Contam. Toxicol.:111-160.
Buck, R.C., Franklin, J., Berger, U., Conder, J.M., Cousins, I.T., de Voogt, P., Jensen, A.A., Kannan, K., Mabury, S.A., and van Leeuwen, S.P.J. (2011) Perfluoroalkyl and polyfluoroalkyl substances in the environment: terminology, classification, and origins. Integr. Environ. Assess. Manag. 7(4), 513-541.
Ignat’ev, N.V., Willner, W., and Sartori, P. (2009) Electrochemical fluorination (Simons process) – A powerful tool for the preparation of new conducting salts, ionic liquids and strong Brǿnsted acids. J. Fluorine Chem. 130(12), 1183-1191.
Naile, J., Garrison, A.W., Avants, J.K., and Washington, J.W. Isomers/Enantiomers of Perfluorcarboxylic Acids: Method Development and Detection in Environmental Samples. Chemosphere 44, 1722-1728.
OECD (2021), Reconciling Terminology of the Universe of Per- and Polyfluoroalkyl Substances:
Recommendations and Practical Guidance, OECD Series on Risk Management, No. 61, OECD
Publishing, Paris.
Sartori, P. and Ignat’ev, N.V. (1988) The actual state of our knowledge about mechanism of electrochemical fluorination in anhydrous hydrogen fluoride. J. Fluorine Chem. 87(2(, 157-162.
Sasaki, T., Egami, A., Yajima, T., Uekusa, H., and Sato, H. (2018) Unusual Molecular and Supramolecular Structures of Chiral Low Molecular Weight Organochelators with Long Perfluoroalkyl Chains. Crystal Growth and Design 18(7) 4200-4205.
Tuve, R.L. amd Jablonksi, E.J. (1966) US 3,258,423 Patent June 28, 1966 “Method Of Extinguishing Liquid Hydrocarbon Fires”, assignors to the United States of America as represented by the Secretary of the Navy. Filed Sept. 4, 1963, Ser. No. 306,665.
Vyas, S.M., Kania-Korwel, I., Lehmler, H.J. (2007) Differences in isomer composition of perfluorooctanoylsulfonyl (PFOS) derivatives. J. Environ. Sci. Health and Toxic Hazard Substance Environ. Eng. 42, 249-255.
Wang, Y., Beeson, S., Benskin, J.P., De Silva, A.O., Genuis, S.J., and Martin J.W. (2011) Enantiomer Fractions of Chiral Perfluoroctanesulfonate (PFOS) in Human Sera. Environ. Sci. Technol. 45(20) 8907-8914.
