Del AFFF al F3 : Historia – Parte 1
La química moderna ha creado muchos cientos de miles de compuestos químicos, que encontramos como parte de nuestra vida diaria. De hecho, sería muy difícil pasar un día sin estar en contacto con alguna clase de moléculas – sustancias perfluoroalkil o PFAS – que han sido explotadas comercialmente desde el final de la Segunda Guerra Mundial en los últimos 75 años.
Incluso si pudiéramos calificar la química como un milagro de la ciencia, vale la pena saber que la química ha sido abordada por los egipcios 3.000 años antes de Cristo, y más tarde fue estudiada por los antiguos griegos que describieron la combinación de los 5 elementos : tierra, aire, fuego, agua y éter. Esta teoría fue ampliamente aceptada durante más de 1.000 años.
La base de la química moderna, como ahora la entendemos, se estableció en los últimos 300 años. Se logró la naturaleza del átomo, la identificación de compuestos atómicos, la primera síntesis moderna.
En 1.906, Frédéric Henri Moissan (1852-1907), químico francés quien trabajó en París en la École Supérieure de Pharmacie, aisló por primera vez el gas flúor elemental F2, un descubrimiento por el que fue galardonado con el Premio Nobel de Química en 1.906. El fluoruro de hidrógeno obtenido del fluospar había sido identificado por el renombrado químico sueco Karl Wilhelm Scheele, algunos años antes.
Los años posguerra, después de la Primera Guerra Mundial a mediados de la década de 1.930, inició el apogeo de la industria química alemana, especialmente en lo que respecta a los nuevos tintes sintéticos. La química del flúor comenzó a tener un papel comercial – un tinte rojo Naftol AS, utilizado como el color rojo oficial de la bandera nazi, el Indanthrene Blue, utilizado como componente de ‘Flieger Grau’ o Pilot Grey, y el color azul-gris de los uniformes de la Luftwaffe, ambos contenían un grupo metilo fluorado, CF3, que ayudó a prevenir el desvanecimiento. Los químicos que trabajaban para DuPont produjeron el primer tejido industrial totalmente sintético, el polímero Nylon.
¡Desde este punto los químicos nunca han dejado de inventar nuevos compuestos!
Cuando pensamos en productos químicos, es importante saber que, muchos si no la mayoría de los compuestos sintéticos ahora disponibles comercialmente, son producidos por la industria petroquímica. Desde la invención del motor de combustión interna térmica, la gasolina y los productos derivados del petróleo, se han vuelto cada vez más importantes para muchas actividades humanas, pero están asociados con un alto riesgo de incendio: el fuego.
La naturaleza de este riesgo puso en evidencia la necesidad de abordar estos incendios a menudo catastróficos. A principios de los años 40, se desarrolló espuma proteínica hecha de cuerno y pezuña, un desecho de matadero, para controlar los incendios de hidrocarburos de clase B, por ejemplo, los que involucran petróleo, gasolina, combustible de aviones y solventes.
En 1949 una empresa química de fama mundial, 3M Company Minnesota, industrializó el proceso de fluoración electroquímica (ECF) de Simons para la fabricación de compuestos perfluorados (PFC), tales como aminas, ácidos carboxílicos y sulfónicos en los que los hidrógenos de la cadena de carbono han sido totalmente sustituidos por flúor. Joseph Simons había descubierto el proceso ECF, mientras trabajaba en el Pennsylvania State College en la década de 1.930, pero no pudo publicar su trabajo hasta después de la Segunda Guerra Mundial porque la química del flúor era esencial para la purificación del uranio como parte del Proyecto Manhattan.
En 1953 la estructura de Scotchgard fue descubierta accidentalmente por Patsy Sherman y Sam Smith, trabajando para la Compañía 3M, mientras trabajaba en una goma para líneas de combustible para aviones. Tres años más tarde, en 1956, la compañía 3M lanzó Scotchguard al mercado. Este tratamiento de tejidos, textiles y cuero se basa en un derivado del PFOS que contiene N-Etil-PFOSA y protege la fibra tratada del agua, del aceite y otros líquidos contra manchas.
Curiosamente, el N-Etil-PFOSA conocido como sulfluramida, fue desarrollado originalmente para matar hormigas, cucarachas y termitas, y todavía se usa hoy en día como insecticida sulfluramida, contra hormigas cortadoras de hojas en Brasil. La sal de litio del PFOS se desarrolló para matar avispas, pero es altamente tóxica para las abejas.
El PFOS, – ácido sulfónico perfluoro-octil – y sus derivados se volvieron cruciales para el desarrollo de espumas acuosas formadoras de película (AFFF) de clase B eficaces contra los incendios de hidrocarburos líquidos y solventes.
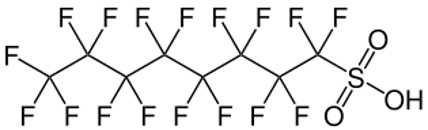
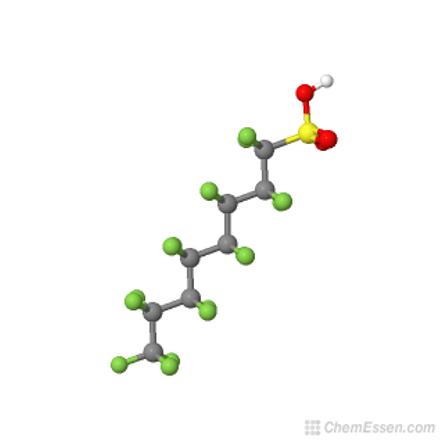
Figura 1. Estructura del PFOS, ácido perfluoro-octil sulfónico.
Durante la década de 1.960, el Laboratorio de Investigación Naval del Departamento de la Armada de los Estados Unidos, en colaboración con la Compañía 3M, comenzaron a desarrollar espumas contra incendios basadas en el PFOS. Luego en junio de 1.966 se concedió una patente para la espuma antiincendios AFFF para extinguir los incendios de hidrocarburos líquidos.
A finales de los años 60, una serie de grandes incendios de combustible suceden a bordo de los buques de la Marina de los Estados Unidos, causando grandes pérdidas de vidas y daños a la Marina de los Estados Unidos:
(i) 1.966: USS Oriskany – mueren 44 marineros a causa del fuego
(ii) 1968: USS Forrestal – durante el servicio activo en el Golfo de Tonkin en la Guerra de Vietnam, debido al mal funcionamiento y disparo accidental de un cohete Zuni de caza, en la cubierta de vuelo de este súper portador se generó un incendio catastrófico de combustible de aviación, que cobró la vida de 134 tripulantes, hiriendo muchos más, y destruyendo cerca de 50 aviones, causando daños por un valor de 72 millones de dólares, y dejando el buque incapacitado para el servicio activo.

(iii) 1.969: USS Enterprise – en un incendio a bordo mueren 28 marineros.
Estos incendios importantes llevaron al Departamento de la Marina de los Estados Unidos, a ordenar el uso de la espuma contra incendios AFFF, recientemente desarrollada, y que la empresa 3M estaba fabricando para el ejército estadounidense .
Los compuestos perfluorados se habían utilizado con éxito para crear las AFFF, y las marcas LightWater y alcohol-resistente ATC de 3M se convirtieron en la referencia para los incendios de hidrocarburos líquidos desde la década de 1.970 hasta mayo de 2.000. cuando la Compañía 3M, anunció que estaba eliminando gradualmente la química del PFOS basada en motivos ambientales. De hecho, la AFFF había conquistado el mundo de la lucha contra incendios y fue vista durante décadas como la respuesta definitiva a la extinción de grandes incendios de hidrocarburos (petróleo y gasolina), tanto para uso militar como civil, especialmente por la aviación y las industrias petroquímicas.
Durante los años 70 se desarrolló una tecnología alternativa basada en el proceso de telomerización. Esta tecnología proporcionó una alternativa al proceso ECF e introdujo una nueva clase perfluoroquímica en el mercado. Mientras que el proceso ECF produjo principalmente PFOS contaminantes, con homólogos pares e impares de PFOS como PFHxS (~5-8 % p/p), ácido sulfónico perfluorohexano, así como isómeros de cadena ramificada, la telomerización produjo solo un número par de cadenas alkil lineal. La característica de los derivados fluorotelómeros es una estructura de perfluoroalkil unida por un grupo de dimetileno -CH2-CH2- a un grupo funcional que podría ser negativo (aniónico), positivo (catiónico) o tanto negativo como positivamente cargado (anfótero).
La mayoría de las espumas contraincendios AFFF, basadas en fluorotelómeros modernas, conocidas como espumas ‘’C6 puras’’, se basan en derivados de ácido 6:2 fluororelómero sulfónico (6:2FTS), o un análogo tioéter, que contiene una cadena C6 perfluoroalkil unida a un grupo funcional cargado (CH2)2). 6:2FTS contiene una cadena C8 y su estructura se muestra a continuación. Su similitud con el PFOS es clara, pero los grupos CH2 hacen que se comporte de manera muy diferente en términos de su perfil PBT. Todas las cadenas de perfluoroalkil y sus productos de degradación son extremadamente persistentes desde el punto de vista ambiental (vP), pero con diferente bioacumulación o potencial tóxico.
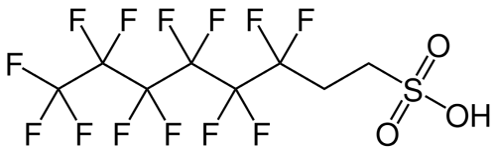
Figura 2. Estructura de 6:2FTS
Sin embargo, las primeras espumas fluorotelómeras contenían tanto 6:2FTS como cantidades sustanciales de derivados 8:2FTS. Esto era un problema ya que el 8:2FTS podía degradarse a un producto final estable ácido perfluoroctanoico o PFOA que tenía toxicidad sustancial. Este problema se ha resuelto esencialmente como resultado del Programa de Administración de PFOA 2010-2015, con el PFOA residual o sus precursores reducidos a menos de 25 partes por mil millones (ppb).
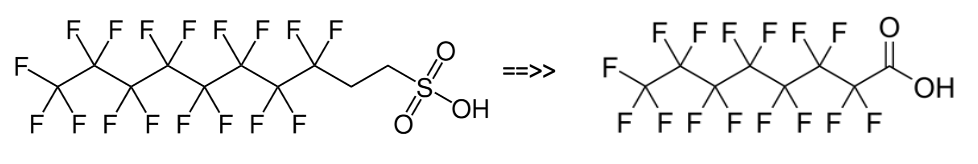
Figura 3. 8: Desglose de 2FTS por PFOA
Desde la década de 1.970, hasta finales de la década de 1.990, muchos fabricantes de espuma contra incendios aparecieron en el mercado, desarrollando y ofreciendo una amplia gama de espumas diferentes para los usuarios finales. Entre ellas figuraban las espumas de clase B AFFF, AFFF-AR (resistentes al alcohol), fluoroproteína formadora de película (FFFP) y fluoroproteína (FP). En este período también se desarrollaron espumas de clase A específicamente destinadas a los incendios carbonosos sólidos, como los incendios de edificios estructurales o forestales.
El 16 de mayo del año 2.000, la empresa 3M anunció abruptamente la eliminación gradual de su actividad en la química, basada en el PFOS para la producción de fluoroquímicos, que afecta no sólo a las espumas contra incendios sino también a una amplia gama de productos domésticos y comerciales. Este anuncio se justificaba por la responsabilidad de la empresa en materia de medio ambiente, ya que se confirmó que las sustancias perfluoroalkil C8 (PFAS) fabricadas con tecnología ECF, planteaban una amenaza para el medio ambiente, con la contaminación que se había extendido por todo el mundo afectando a una amplia gama de compartimentos ambientales, así como a la biota, incluido el hombre.
En los siguientes 2 a 3 años la empresa 3M, había suspendido todas las actividades relacionadas con la química basada en el PFOS, con una retirada total del mercado de espumas contra incendios, sustituyéndolo por una química basada en el PFBS (sulfonato de perfluorobutilo) de cadena más corta. Sin embargo, tanto en China como en la India continuó la producción de derivados del PFOS y del PFHxS mediante el proceso ECF.
Con la eliminación de 3M de la química del PFOS y su retiro del mercado de la espuma contra incendios, otros fabricantes importantes de fluoroquímicos y espumas con PFAS subrayaron que consideraban que la química de fluorotelómeros era ‘segura’ y, de hecho, respetuosa con el medio ambiente, ya que no tenía nada que ver con la química del ECF y los productos no podían contener ni PFOS ni PFOA. El mercado de espumas contra incendios pasó a los productos AFFF basados en fluorotelómeros en los sucesivos años 2.000-2.010.
A partir del año 2.002 tuvo lugar un debate animado y a veces acrimonioso entre los fabricantes de PFAS y AFFF – bajo los auspicios de una asociación comercial, la Fire Fighting Foam Coalition (FFFC), financiada principalmente por la industria fluoroquímica – y fabricantes independientes, especialmente de espumas sin flúor nacientes (F3), reguladores y expertos científicos de la academia.
Esta discusión dio lugar a una serie de seminarios internacionales, conferencias y cientos de publicaciones en la literatura revisada por pares sobre las consecuencias nefastas de sustituir los PFOS por los fluorotelómeros. En este momento, el principal foro internacional para discutir los avances en la tecnología de espuma contra incendios resultó ser la serie Reebok de conferencias de espuma, celebradas en Manchester y Bolton en el Reino Unido, 2.002, 2.004, 2.007, 2.009 y 2.013.
A partir del año 2.002, varios fabricantes independientes -más pequeños- de espumas comenzaron a ofrecer espumas sin flúor (F3), de primera generación de clase B, como alternativas más sostenibles desde el punto de vista ambiental a las espumas que contienen PFAS. Durante los siguientes 10 años el debate se fortaleció, impulsado por estudios científicos publicados que concluyeron que la química de los telómeros representaba una amenaza para el medio ambiente. Los primeros telómeros fueron mezclas de derivados 6:2 y 8:2. Esto demostró que el material 8:2 era un precursor potencial para la generación de PFOA (ácido perfluorooctanoico o C8) extremadamente persistente desde el punto de vista ambiental mediante su degradación, que posteriormente se asoció con efectos a largo plazo para la salud. En ese momento esto fue enérgicamente impugnado por los representantes que abogaban por la industria fluoroquímica que asistían a las conferencias Reebok.
Sin embargo, como resultado de la presión de la EPA estadounidense, muchos grandes fabricantes de materias primas adoptaron el Programa de Administración de PFOA 2.010-2.015, con el objetivo de reducir el uso de PFOA o sus precursores. Las mejoras en la purificación de los derivados del fluorotelómero dieron lugar a una reducción del material relacionado con el PFOA al menos de 25 ppb, proporcionando los llamados derivados fluorotelómeros ‘puros C6’. El Programa de Administración llevó a un cambio en las formulaciones de espuma que anteriormente contenían fluorotelómeros C6/C8 a un llamado reemplazo de ‘caída’ que contenía predominantemente fluorotelómero C6.
Desafortunadamente, este cambio no fue tan simple como se suponía y los fabricantes de espuma tuvieron que reformular y aumentar el contenido fluoroquímico total para lograr un rendimiento similar en comparación con las formulaciones anteriores de C6/C8. ¡Lamentablemente, los usuarios finales ni siquiera se dieron cuenta de este cambio!
Alrededor de la misma época, los estudios científicos acumularon evidencia de que incluso el C6 hiper puro NO era una alternativa adecuada, sino un ‘sustituto lamentable’ y el debate pasó a otro nivel. El año 2.015 marcó un cambio radical en el debate del PFAS. La industria o los reguladores fluoroquímicos ya no negaban la toxicidad del PFOA y los periodistas científicos señalaron la cuestión a la atención del público.
Una serie de declaraciones públicas firmada por científicos de todo el mundo – la Declaración de Helsingør del 2.014, la Declaración de Madrid del 2.014 y la Declaración de Zúrich del 2.018 – plantearon preocupaciones sobre el uso continuo de PFAS como contaminantes planetarios importantes y su impacto a largo plazo en el medio ambiente. Adicionalmente una importante publicación en el año 2.020, planteó el argumento de que todos los PFAS, deben ser tratados como una clase química debido a sus problemas ambientales comunes, en lugar de productos químicos individuales.
El Convenio de Estocolmo de las Naciones Unidas y su Comité de Examen de Contaminantes Orgánicos Persistentes (CECOP) han añadido PFOS, PFHxS y PFOA a los anexos apropiados que prohíben o restringen su uso (2.018-2.022).
Países como Alemania y Noruega, o estados individuales como Queensland en Australia, han estado a la vanguardia en la regulación del uso de PFAS, especialmente para uso altamente dispersivo como espumas contra incendios.
Algunos países no están esperando las decisiones de las Naciones Unidas para regular el uso de PFAS. En Europa, el PFOS está prohibido desde el año 2.011 y el PFOA desde el año 2.018; las discusiones actuales apuntan a detener completamente el uso de todos los PFAS con carbonos de C4 a C20 con una fecha límite de 2025, En previsión de estas restricciones, muchas industrias están pasando a la tecnología sin flúor. En los EE.UU., el cambio está siendo impulsado principalmente por el costo de los litigios con miles de casos contra la industria fluoroquímica, incluidos los fabricantes de espuma.
Continuará en la parte 2
